题目内容
12.已知室温时,0.1mol/LCH3COOH在水中有0.1%发生电离,回答下列问题:(1)写出CH3COOH的电离方程式CH3COOH?CH3COO-+H+
(2)该溶液中PH=4
(3)CH3COOH的电离平衡常数K=1×10-7;
(4)由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍.
(5)下列方法中,可以使0.10mol•L-1CH3COOH溶液中CH3COOH电离程度增大的是bc.
a.通入HCl气体 b.加入少量0.10mol•L-1的NaOH溶液
c.加水稀释 d.加入少量冰醋酸
e.加入少量氯化钠固体.
分析 (1)醋酸是弱酸,电离可逆;
(2)利用氢离子的浓度计算pH;
(3)根据电离度及离子的浓度计算电离平衡常数;
(4)HAc电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度;
(5)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离,由此分析解答.
解答 解:(1)醋酸是弱酸,电离可逆,电离方程式为CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(2)醋酸电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故答案为:4;
(3)由HAc═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为=$\frac{[{H}^{+}]•[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故答案为:1×10-7;
(4)醋酸电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,
故答案为:106;
(5)a.通入HCl气体,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.加入NaOH溶液,中和了溶液中的氢离子,则醋酸的电离程度增大,故正确;
c.加水稀释,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故错误;
故答案为:bc.
点评 本题考查弱酸的电离,明确离子的浓度,温度、浓度等对电离平衡的影响及离子积的计算即可解答,难度不大.

| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;(2)请写出Al与X元素最高价氧化物所对应水化物的溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)判断非金属性Z>Y(填“>”或“<”),请用离子方程式进行说明:Cl2+H2S=S+2H++2Cl-或Cl2+S2-=S+2Cl-.
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
| A. | H2SO4 | B. | H2 | C. | KCl | D. | NaOH |
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应 |
 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.(1)已知:Ksp[Al(OH)3]=1.3×10-33.实验室利用Al2(SO4)3溶液与氨水反应制备Al(OH)3,若使反应后的溶液中c(Al3+)<1.3×10-6 mol•L-1,应控制溶液pH5.
(2)Al(OH)3可添加到可燃性高聚物中用作阻燃剂,请写出两条其阻燃的原因:Al(OH)3受热分解吸热,抑制聚合物升温;使可燃性高聚物浓度下降;或受热分解放出水汽稀释可燃性气体和氧气的浓度;或分解产生的Al2O3可隔绝氧气;或使塑料等高聚物炭化而不易产生挥发性物质,从而阻止火焰蔓延.
(3)胃舒平药片中含有Al(OH)3和三硅酸镁(Mg2Si3O8•5H2O)等.通过下列实验测定药片中Al(OH)3含量.
已知:测定过程中,EDTA与Al3+、Mg2+、Zn2+均按物质的量1:1反应,发生反应的pH如表所示:
| 金属离子 | Al3+ | Zn2+ | Mg2+ |
| 与EDTA反应的pH | 4 | 5~6 | 9.5~10 |
步骤二:取10片(0.45g/片)胃舒平研细,称取2.2500g研细后的粉末,加入足量盐酸和蒸馏水,煮沸、过滤、洗涤沉淀2次,洗涤液与滤液合并,定容成250mL溶液A.
步骤三:移取5.00mL溶液A,调pH=4,准确加入步骤一中配制的EDTA溶液25.00mL,煮沸,充分反应后,调pH为5~6并加入指示剂,以步骤一中配制的Zn(NO3)2标准溶液滴定过量的EDTA至终点,消耗Zn(NO3)2标准溶液20.00mL.
①计算每片胃舒平中Al(OH)3的质量.
②步骤一滴定终点时俯视读数,会使测得胃舒平药片中Al(OH)3的质量偏小(填“偏大”、“偏小”或“不变”).
Ⅱ、工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g) CH3OH(g)△H (CO结构式为C≡O).又知某些化学键的键能(断开 1mol化学键时所需要的最低能量)数值如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
Ⅲ、电化学降解NO3-的原理如图1所示.

①电源 A 极为正极(填“正极”或“负极”),阴极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
②若电解过程中转移了 1mol 电子,则膜左侧电解液的质量减少量为9g.
Ⅳ、已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,10min反应达平衡.反应物浓度随时间变化关系如图2.
①图2中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化.下列不能说明该反应已达到平衡状态的是B.
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
②前 10min内化学反应的平衡常数K(b) 值为$\frac{10}{9}$
③反应 25min 时,若只改变了某一个条件,使曲线发生如图2所示的变化,该条件可能是增大NO2的浓度(用文字表达);其平衡常数 K(d)=K(b)(填“>”、“=”或“<”).
 ,ZX与水反应放出的气体的化学式为H2.
,ZX与水反应放出的气体的化学式为H2.

 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应. .
.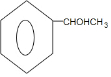 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式)
(填结构简式)