题目内容
7.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2+H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见表(表中t1>t2):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应 |
分析 由表格中数据可知,
CO(g)+H2O(g)?CO2+H2(g)
开始 1.2 0.6 0 0
转化 0.40 0.40 0.40 0.40
t 0.80 0.20 0.40 0.40
可知t1时达到平衡,t1、t1均为平衡状态,
A.结合v=$\frac{△c}{△t}$计算;
B.起始时向容器中充入0.60 molCO和1.20 molH2O,开始的量及转化的量相同;
C.平衡体系中再通入0.20 mol H2O(g),促进CO的转化,但H2O的量增大;
D.K=$\frac{0.20×0.20}{0.40×0.10}$=1,温度升至800℃,上述反应平衡常数变为1.64,可知升高温度平衡正向移动.
解答 解:由表格中数据可知,
CO(g)+H2O(g)?CO2+H2(g)
开始 1.2 0.6 0 0
转化 0.40 0.40 0.40 0.40
t1 0.80 0.20 0.40 0.40
可知t1时达到平衡,t1、t1均为平衡状态,
A.反应在t1min内的平均速率为v(H2)=$\frac{\frac{0.40mol}{2L}}{{t}_{1}min}$=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1,故A错误;
B.起始时向容器中充入0.60 molCO和1.20 molH2O,开始的量及转化的量相同,则到达平衡时,n(CO2)=0.40 mol,故B正确;
C.平衡体系中再通入0.20 mol H2O(g),促进CO的转化,但H2O的量增大,则达到新平衡时CO转化率增大,H2O的体积分数增大,故C正确;
D.K=$\frac{0.20×0.20}{0.40×0.10}$=1,温度升至800℃,上述反应平衡常数变为1.64,可知升高温度平衡正向移动,即正反应为吸热反应,故D正确;
故选A.
点评 本题考查化学平衡计算,为高频考点,把握表格中数据的应用、平衡移动、三段法计算为解答的关键,侧重分析与计算能力的考查,注意选项B为解答的易错点,题目难度不大.

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案| A. | 加入氢氧化钠溶液,产生蓝色淀,一定有Cu2+ | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ca2+ | |
| D. | 加入过量盐酸,振荡、静置,再滴入氯化钡溶液,有白色沉淀产生,一定有SO42- |
| A. | 4种 | B. | 8种 | C. | 13种 | D. | 16种 |
| A. | Mg、Al、K | B. | F、O、N | C. | As、P、N | D. | O、S、Cl |
 3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
3-苯基丙烯醛是一种被广泛应用在食品加工中的高效低毒食品添加剂,下列是用其合成聚酯F的路线示意图:
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr. +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$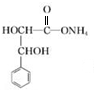 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 或
或 . (任写一种)
. (任写一种) ,现以甲苯和乙醛为原料制备3-苯基丙烯醛
,现以甲苯和乙醛为原料制备3-苯基丙烯醛 ,设计合成线路(其无机试剂任选),合成线路示意图示例如下:
,设计合成线路(其无机试剂任选),合成线路示意图示例如下:

 .
. .
. .
. 或
或 .
.