题目内容
10. 用18.4mol•L-1的浓H2SO4配制100mL浓度为1mol•L-1的稀H2SO4,其操作可分为以下各步:
用18.4mol•L-1的浓H2SO4配制100mL浓度为1mol•L-1的稀H2SO4,其操作可分为以下各步:A.用量筒量取5.4ml浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒搅拌;
B.用约30mL蒸馏水,分成3次洗涤烧杯和玻棒,将每次洗涤液都注入容量瓶中;
C.将稀释后的H2SO4小心转移到100mL容量瓶里;
D.检查100mL容量瓶口部是否会发生滴漏;
E.用量筒加蒸馏水至容量瓶中液面接近刻度2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴滴加蒸馏水至液面最低点和刻度线相平,试填空
①正确的操作顺序为(用字母填写)DACBEGF.
②进行A步操作时,应选择下列量器a(填序号).
a.10ml量筒 b.50ml量筒 c.100ml量筒
如果对装有浓H2SO4的量筒读数如右图所示,配制的稀H2SO4的浓度将偏高(偏高、偏低、无影响)
③进入A步操作后,必须冷却至室温后才能进行C操作.
分析 ①依据配制一定物质的量浓度溶液的一般步骤排序;
②依据量筒选择规则:“大而近”,应选择量程略大于等于量取溶液体积的量筒;
仰视量筒读数,导致量取的浓硫酸体积偏大,溶质硫酸的物质的量偏大,依据C=$\frac{n}{V}$进行误差分析;
③依据容量瓶正确使用方法解答.
解答 解:①用浓溶液配制一定物质的量浓度溶液的一般操作为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:DACBEGF;
故答案为:DACBEGF;
②量依据量筒选择规则可知量取5.4mL溶液,应选择10mL量筒;
仰视量筒读数,导致量取的浓硫酸体积偏大,溶质硫酸的物质的量偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏高;
故答案为:a; 偏高;
③容量瓶为精密仪器,不能用来盛放过热或者过冷的液体,所以移液前应冷却到室温;
故答案为:冷却至室温.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意量筒、容量瓶规格的选择,注意容量瓶使用的方法,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
1.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-下列选项中的数字与离子方程式中的a.b.c.d.e.f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
5.在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是
①FeCl3溶液与Cu 的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3
③FeCl3溶液与KI 的反应 ④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体
⑤FeCl3溶液与H2S 的反应 ⑥FeCl3溶液与NaHCO3溶液的反应
⑦配制FeCl3溶液需加入一定量的盐酸( )
①FeCl3溶液与Cu 的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3
③FeCl3溶液与KI 的反应 ④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体
⑤FeCl3溶液与H2S 的反应 ⑥FeCl3溶液与NaHCO3溶液的反应
⑦配制FeCl3溶液需加入一定量的盐酸( )
| A. | ①④⑥ | B. | ②③⑤⑥ | C. | ②④⑥⑦ | D. | ①②③④⑤⑥⑦ |
2.下列化学方程式能用H++OH-═H2O表示的是( )
| A. | 硫酸和氢氧化钡 | B. | 氢氧化铜和盐酸 | C. | 盐酸和氨水 | D. | 氢氧化钠和硫酸 |
19.W、X、Y是原子序数依次增大的同一短周期元素.W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y.下列说法不正确的是( )
| A. | 原子半径W>X>Y | B. | W2Y的电子式为: | ||
| C. | 元素的金属性W<X | D. | W2Y2中既有离子键,又有共价键 |
 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: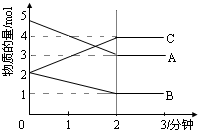 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: