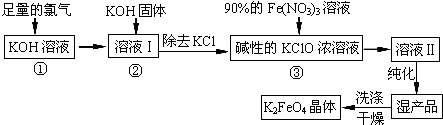
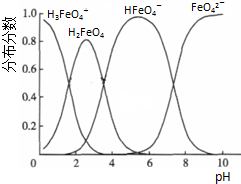
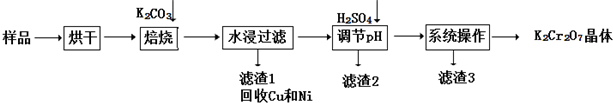
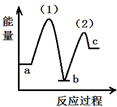
题目内容
17.如图是部分短周期元素最外层电子数与原子序数的关系图,下列说法正确的是( )
| A. | 原子半径:A<B<C<D | |
| B. | E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 | |
| C. | 气态氢化物稳定性:D>I>G>H | |
| D. | E和C元素形成的化合物中只存在离子键 |
分析 都是短周期元素,由最外层电子数与原子序数关系可知,A、B、C、D处于第二周期,A、B、C、D的最外层电子数依次为4、5、6、7,故A为碳元素、B为N元素、C为O元素、D为F元素;E、F、G、H、I处于第三周期,最外层电子数分别为1、3、5、6、7,故E为Na元素、F为Al元素、G为P元素、H为S元素、I为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:都是短周期元素,由最外层电子数与原子序数关系可知,A、B、C、D处于第二周期,A、B、C、D的最外层电子数依次为4、5、6、7,故A为碳元素、B为N元素、C为O元素、D为F元素;E、F、G、H、I处于第三周期,最外层电子数分别为1、3、5、6、7,故E为Na元素、F为Al元素、G为P元素、H为S元素、I为Cl元素.
A.同周期自左而右原子半径减小,故原子半径A>B>C>D,故A错误;
B.E、F和H三种元素相应的最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝、硫酸,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,与氢氧化钠、硫酸反应,故B正确;
C.同周期自左而右,非金属性增强,非金属性越强,气态氢化物越稳定,故气态氢化物的稳定性H2O>PH3,故C错误;
D.N元素、O元素形成的化合物只存在共价键,故D错误,
故选B.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意整体把握元素周期表的结构.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
7.工程技术人员焊接铁轨时,利用了如下反应:Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应类型属于( )
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
8.下列离子方程式书写正确的是( )
| A. | 醋酸除水垢:2CH3COO-+2H++CaCO3═(CH3COO)2Ca+CO2↑+H2O | |
| B. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 稀硫酸除铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| D. | 酸性条件下KIO3与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- |
5.用化学方法不能实现的是( )
| A. | 生成一种新分子 | B. | 生成一种新离子 | ||
| C. | 生成一种新同位素 | D. | 生成一种新单质 |
6.从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
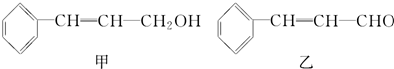
丙(见下表)
(1)甲的分子式为:C9H10O
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
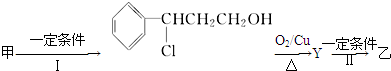
反应Ⅱ的化学方程式为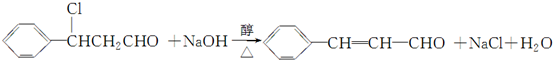 (注明反应条件).
(注明反应条件).
(3)已知:RCH═CHR′$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R′CHO;
2CHO$→_{ii.H+}^{i.浓NaOH}$HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
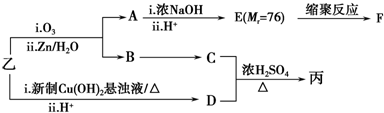
①下列物质不能与C反应的是c(选填序号).
a.金属钠 b.乙酸 c.Na2CO3溶液 d. HBr
②写出F的结构简式 .
.
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式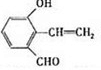 .
.
a.苯环上连接三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为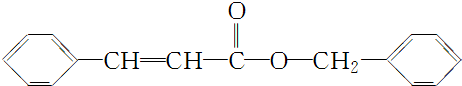 .
.
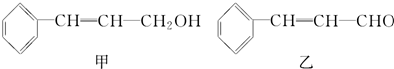
丙(见下表)
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
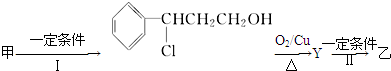
反应Ⅱ的化学方程式为
 (注明反应条件).
(注明反应条件).(3)已知:RCH═CHR′$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R′CHO;
2CHO$→_{ii.H+}^{i.浓NaOH}$HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):

①下列物质不能与C反应的是c(选填序号).
a.金属钠 b.乙酸 c.Na2CO3溶液 d. HBr
②写出F的结构简式
 .
.③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式
 .
.a.苯环上连接三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为
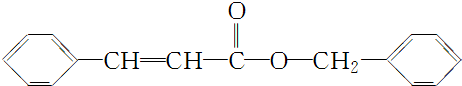 .
.
7.下列说法正确的是( )
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |