题目内容
6.从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分: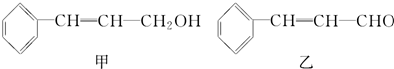
丙(见下表)
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
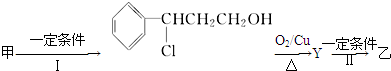
反应Ⅱ的化学方程式为
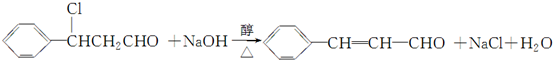 (注明反应条件).
(注明反应条件).(3)已知:RCH═CHR′$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R′CHO;
2CHO$→_{ii.H+}^{i.浓NaOH}$HCOOH+CH3OH
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
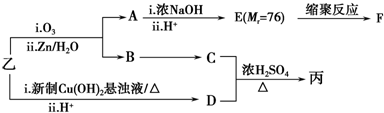
①下列物质不能与C反应的是c(选填序号).
a.金属钠 b.乙酸 c.Na2CO3溶液 d. HBr
②写出F的结构简式
 .
.③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体的结构简式
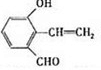 .
.a.苯环上连接三种不同官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色
④综上分析,丙的结构简式为
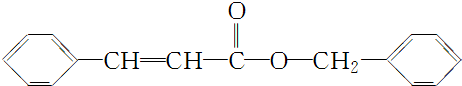 .
.
分析 (1)根据甲的结构简式可知其分子式;
(2)由转化关系可知Y为 ,发生消去反应生成
,发生消去反应生成 ;
;
(3)根据乙的结构简式和题干中所给信息,可知A是乙二醛,B是苯甲醛,乙在加热条件下与新制备氢氧化铜反应生成酸,所D为 ,则C应为醇,因B为苯甲醛,则C为苯甲醇,E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,以此解答该题.
,则C应为醇,因B为苯甲醛,则C为苯甲醇,E是相对分子质量为76,结合题给信息可知应为OH-CH2-COOH,以此解答该题.
解答 解:(1)根据甲的结构简式可知其分子式为C9H10O,故答案为:C9H10O;
(2)由转化关系可知Y为 ,反应Ⅱ为
,反应Ⅱ为 发生消去反应生成
发生消去反应生成 ,反应的方程式为:
,反应的方程式为: ,
,
故答案为: ;
;
(3)根据乙的结构简式和题干中所给信息,可知A是乙二醛,B是苯甲醛,所以D是苯甲酸,苯甲醛易被还原为苯甲醇,苯甲醇和苯甲酸之间能发生酯化反应,所以C是苯甲醇,属于醇类,能和金属钠反应、能和氢卤酸反应、能和酸之间发生酯化反应,根据题意信息,E是相对分子质量为76的OH-CH2-COOH,本身能发生缩聚反应生成 ,
,
①C是苯甲醇,属于醇类,能和金属钠反应、能和氢卤酸反应、能和酸之间发生酯化反应,Na2CO3溶液不能与C反应,故答案为:c;
②OH-CH2-COOH本身能发生缩聚反应生成 ,F的结构简式为:
,F的结构简式为: ,故答案为:
,故答案为: .
.
③D的同分异构体,能发生银镜反应,则含有醛基,能与Br2/CCl4发生加成反应,则含有不饱和键,遇FeCl3溶液显示特征颜色,则含有酚羟基,能同时满足各个条件的异构体结构简式为: ,
,
故答案为: ;
;
④综上分析,D为 ,C是苯甲醇,二者之间可以发生酯化反应得到丙,所以丙的结构简式为
,C是苯甲醇,二者之间可以发生酯化反应得到丙,所以丙的结构简式为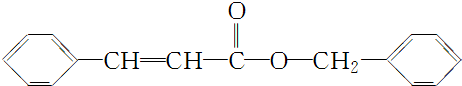 ,
,
故答案为: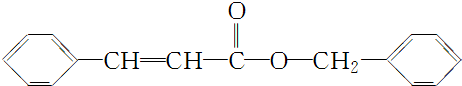 .
.
点评 本题考查有机物推断,同时考查学生获取信息、加工信息、推断能力,根据物质中的官能团确定其具有的性质,注意反应条件的运用,难点是同分异构体种类判断,题目难度中等.

练习册系列答案
相关题目
16.下列关于有机物的说法中正确的是( )
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③易溶于汽油、酒精、苯等有机溶剂的物质都是有机化合物
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2CO3溶液振荡后,静置分液
⑤石油的分馏、裂化和煤的干馏都是化学变化
⑥聚碳酸酯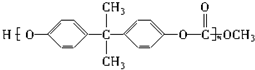 中含有
中含有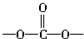 结构.
结构.
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③易溶于汽油、酒精、苯等有机溶剂的物质都是有机化合物
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2CO3溶液振荡后,静置分液
⑤石油的分馏、裂化和煤的干馏都是化学变化
⑥聚碳酸酯
 中含有
中含有 结构.
结构.| A. | ②⑤ | B. | ②④⑥ | C. | ①②③⑥ | D. | ②④⑤ |
17.如图是部分短周期元素最外层电子数与原子序数的关系图,下列说法正确的是( )


| A. | 原子半径:A<B<C<D | |
| B. | E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 | |
| C. | 气态氢化物稳定性:D>I>G>H | |
| D. | E和C元素形成的化合物中只存在离子键 |
14.以下是一些物质的熔沸点数据(常压):
中国科学家用金属钠和CO2在一定条件下制得了金刚石:4Na+3CO2?2Na2CO3+C(s,金刚石)
完成下列填空:
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$.
(2)请写出一条既能提高反应速率又能提高转化率的方法:增大压强
(3)890℃,下列关于该反应的说法正确的是b(选填序号).
a.容器内气体的平均式量不再变化,则反应一定达到平衡
b.容器内固体质量不再变化,则反应一定达到平衡
c.反应起始至平衡,气体的密度不断增大
d.反应起始至平衡,容器内的压强不断增大
(4)890℃,若该反应在10L密闭容器、常压下进行,反应4h,固体质量增加56克,则二氧化碳的反应速率为0.35mol/(L•h)
(5)若温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将增大(选填“增大”“减小”“不变”),
(6)若反应后要得到纯净的金刚石,请写出必要的实验操作步骤.冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石
(7)在此反应中,同时还会有石墨生成,已知:C(s,石墨)?C(s,金刚石)-1.9KJ,若升高温度,生成的碳单质中,金刚石的含量将增大(选填“增大”“减小”“不变”).等物质的量的石墨和金刚石中,化学键的数目较多的是金刚石.
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
完成下列填空:
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式$\frac{1}{{c}^{4}(Na)×{c}^{3}(C{O}_{2})}$.
(2)请写出一条既能提高反应速率又能提高转化率的方法:增大压强
(3)890℃,下列关于该反应的说法正确的是b(选填序号).
a.容器内气体的平均式量不再变化,则反应一定达到平衡
b.容器内固体质量不再变化,则反应一定达到平衡
c.反应起始至平衡,气体的密度不断增大
d.反应起始至平衡,容器内的压强不断增大
(4)890℃,若该反应在10L密闭容器、常压下进行,反应4h,固体质量增加56克,则二氧化碳的反应速率为0.35mol/(L•h)
(5)若温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将增大(选填“增大”“减小”“不变”),
(6)若反应后要得到纯净的金刚石,请写出必要的实验操作步骤.冷却后,将反应后容器中的固体取出,加水溶解、过滤、洗涤固体并烘干,可得纯净的金刚石
(7)在此反应中,同时还会有石墨生成,已知:C(s,石墨)?C(s,金刚石)-1.9KJ,若升高温度,生成的碳单质中,金刚石的含量将增大(选填“增大”“减小”“不变”).等物质的量的石墨和金刚石中,化学键的数目较多的是金刚石.
1.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L SO3中含有0.5NA个SO3分子 | |
| B. | 48g O3气体含有3NA个氧原子 | |
| C. | 在1L0.5mol•L-lFeCl3溶液中含有0.5NA个Fe3+ | |
| D. | 1.5 mol NO2与足量水反应,转移的电子数为1.5NA |
11.下列有关金属腐蚀的说法错误的是( )
| A. | 为保护地下钢管不受腐蚀,可使它与锌板或直流电源正极相连 | |
| B. | 在盛水的铁器中,空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆或油脂 | |
| D. | 纯银器表面在空气中因化学腐蚀渐渐变暗 |
18.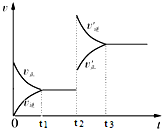 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )| A. | 重新达到平衡后,平衡常数K增大 | B. | t2时刻改变的条件可以是升高温度 | ||
| C. | I2(g)转化率增大,HI平衡浓度增大 | D. | t2时刻改变是可以增大压强 |
16.反应4P+3KOH+3H2O═3KH2PO2+PH3中磷单质发生的变化是( )
| A. | 只被氧化 | B. | 被氧化与被还原的个数比为1:3 | ||
| C. | 只被还原 | D. | 氧化剂与还原剂的质量比是1:3 |
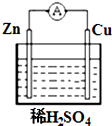 如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:
如图所示,在铜锌原电池中,以稀硫酸为电解质溶液: