题目内容
7.铜及铜的化合物在工农业上具有重要的用途.(1)粗铜进行电解精炼,可获得高纯铜,电解时,阳极材料是:粗铜.
(2)在铁的表面镀上铜可防止铁被腐蚀,但镀层破损后,内部的铁更容易被腐蚀,其原因是:铜镀层破损后,铁与铜在空气中形成原电池,铁比铜活泼,铁做负极,腐蚀加快.
(3)氯化亚铜(CuCl)是一种难溶于水的化工产品,某种利用含铜电镀废水制备CuCl的流程如图1:
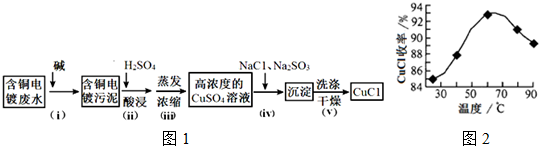
①步骤i加入碱反应后需要进行分离操作,该操作的名称为:过滤.
②步骤 ii主要反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O.
③步骤ⅳ反应的化学方程式为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4.
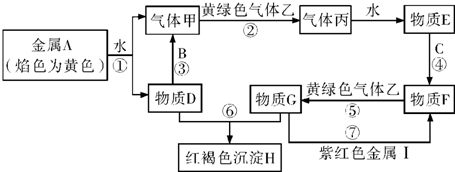
④温度对该流程的CuCl平衡收率影响如图2所示,且随着反应温度升高,会加剧Na2SO3分解(生成X、Y两种化合物),同时促进Cu2(OH)3C1的生成.下列有关说法正确的是BD.
A.结合图2可判断步骤ⅳ反应的△H<0
B.若Na2SO3分解产物的X为Na2S,则Y一定是Na2SO4
C.生成Cu2(OH)3C1是由于CuCl在潮湿空气中被还原
D.该条件下,温度最好控制在60~70°C范围.
分析 (1)粗铜精炼时,粗铜为阳极,纯铜为阴极;
(2)镀层破损后,内部的铁更容易被腐蚀,形成原电池时Fe为负极;
(3)由制备实验流程可知,步骤i加入碱反应后得到含铜的污泥,过滤分离出污泥,再加硫酸溶解含铜的污泥,得到硫酸铜溶液,蒸发浓缩得到高浓度的硫酸铜溶液,由反应物、生成物可知,步骤ⅳ发生2CuSO4+Na2SO3+2NaC1+H2O=2CuC1↓+2Na2SO4+H2SO4,过滤、洗涤、干燥得到CuCl,以此来解答.
解答 解:(1)粗铜精炼时,粗铜为阳极,失去电子,而阴极上铜离子得到电子生成Cu,故答案为:粗铜;
(2)在铁的表面镀上铜可防止铁被腐蚀,但镀层破损后,内部的铁更容易被腐蚀,其原因是铜镀层破损后,铁与铜在空气中形成原电池,铁比铜活泼,铁做负极,腐蚀加快,故答案为:铜镀层破损后,铁与铜在空气中形成原电池,铁比铜活泼,铁做负极,腐蚀加快;
(3)由制备实验流程可知,步骤i加入碱反应后得到含铜的污泥,过滤分离出污泥,再加硫酸溶解含铜的污泥,得到硫酸铜溶液,蒸发浓缩得到高浓度的硫酸铜溶液,由反应物、生成物可知,步骤ⅳ发生2CuSO4+Na2SO3+2NaC1+H2O=2CuC1↓+2Na2SO4+H2SO4,过滤、洗涤、干燥得到CuCl,
①由上述分析可知,步骤i中操作分离污泥与溶液,则为过滤操作,故答案为:过滤;
②步骤 ii中硫酸溶解污泥,则离子反应为Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
③步骤ⅳ反应的化学方程式为2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4,故答案为:2CuSO4+Na2SO3+2NaCl+H2O=2CuCl↓+2Na2SO4+H2SO4;
④A.由图中30℃升高为60℃可知,CuCl平衡收率增大,则该反应△H>0,故A错误;
B.随着反应温度升高,会加剧Na2SO3分解生成X、Y两种化合物,X为Na2S,则Y一定是Na2SO4,为歧化反应,故B正确;
C.发生4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl,CuCl在潮湿空气中被氧化,故C错误;
D.由图可知,因在60℃时CuCl产率最大,则该条件下,温度最好控制在60~70°C范围,故D正确;
故答案为:BD.
点评 本题考查制备实验的设计及电化学应用,为高频考点,把握制备实验流程中的反应及混合物分离方法、电化学原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | Fe3+ | B. | Fe2+ | C. | Al3+ | D. | Cl- |
| A. | 标准状况下,11.2L苯中所含的分子数为0.5NA | |
| B. | 标准状况下,22.4L O2与44.8L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1mol的H3O+和OH-中含有的电子数目均为0.9NA | |
| D. | 2.4g O2和O3的组成的混合气体中所含的氧原子数目为0.15NA |
①CaCO3(s)═CaO(s)+CO2(g)仅在高温下自发:氯酸钾的分解
②2KClO3(s)═2KCl(s)+3O2(g)在任何温度下都自发,下面有几组焓变数据,其中可能正确的是( )
| A. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| B. | △H1=+178.32kJ•mol-1△H2=-78.3kJ•mol-1 | |
| C. | △H1=-178.32kJ•mol-1△H2=+78.3kJ•mol-1 | |
| D. | △H1=+178.32kJ•mol-1△H2=+78.3kJ•mol-1 |
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol)-1
①该反应能否自发进行与温度 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是bc(填字母,下同).
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②该反应的逆反应为放(填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,且a>1 (用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2.
 .
.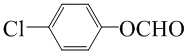 (写一种结构简式)
(写一种结构简式)