题目内容
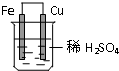 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )| A、正极的反应式为:Cu2++2e-=Cu |
| B、铁片逐渐溶解,反应式为:Fe-3e-=Fe3+ |
| C、负极是电子流入的电极 |
| D、铜片为正极,发生了还原反应,可观察到气泡产生 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中,Fe比Cu易失电子,Fe作负极、Cu作正极,负极上电极反应式为Fe-2e-=Fe2+,正极上电极反应式为2H++2e-=H2↑,电子流入的电极是正极、流出的电极为负极.
解答:
解:A.正极上电极反应式为2H++2e-=H2↑,故A错误;
B.铁失电子而作负极,所以铁片逐渐溶解,电极反应式为Fe-2e-=Fe2+,故B错误;
D.负极是电子流出的电极,故C错误;
D.铜是正极,正极上得电子发生还原反应,电极反应式为2H++2e-=H2↑,所以可观察到气泡产生,故D正确;
故选D.
B.铁失电子而作负极,所以铁片逐渐溶解,电极反应式为Fe-2e-=Fe2+,故B错误;
D.负极是电子流出的电极,故C错误;
D.铜是正极,正极上得电子发生还原反应,电极反应式为2H++2e-=H2↑,所以可观察到气泡产生,故D正确;
故选D.
点评:本题考查了原电池原理,明确正负极的判断、正负极上发生的反应及电子流向即可解答,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列关于实验的相关说法正确的是( )
| A、除去碳酸氢铵粉末中混有的I2:加热使I2升华 |
| B、蒸发结晶时,加热至混合物中的水分完全蒸干 |
| C、过滤时倒入漏斗的过滤液的液面应低于滤纸边缘 |
| D、除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶 |
下列反应的离子方程式正确的是( )
| A、小苏打溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
| B、石灰水与足量的碳酸氢钾溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、大理石跟醋酸溶液反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
| D、过氧化钠与水的反应:2O22-+2H2O═4OH-+O2↑ |
下列各组物质不能形成喷泉现象的是( )
| A、二氧化碳和氢氧化钠溶液 |
| B、氯化氢和氢氧化钠溶液 |
| C、二氧化碳和水 |
| D、氯化氢和水 |
分类是学习和研究化学的-种常用科学方法,下列分类合理的是
①根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
②根据在水溶液或熔融状态下能否导电,将物质分为电解质和非电解质
③根据酸分子中含有的H原子个数将酸分为-元酸、二元酸等
④根据分散质微粒直径大小可以将分散系分为溶液、浊液和胶体
⑤根据是否含氧元素来确定物质是否为氧化物( )
①根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
②根据在水溶液或熔融状态下能否导电,将物质分为电解质和非电解质
③根据酸分子中含有的H原子个数将酸分为-元酸、二元酸等
④根据分散质微粒直径大小可以将分散系分为溶液、浊液和胶体
⑤根据是否含氧元素来确定物质是否为氧化物( )
| A、①②③④ | B、①②⑤ |
| C、①③④ | D、①④ |
下列实验能达到预期目的是( )
| A、为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后再加硝酸钡溶液 |
| B、向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾 |
| C、向煮沸的1mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| D、利用丁达尔效应可区别Na2CO3溶液与Al(OH)3胶体 |