题目内容
8.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是( )| A. | 加少量稀NaOH溶液 | B. | 加入少量NaNO3固体 | ||
| C. | 加入少量NaHSO4固体 | D. | 加入少量CuSO4溶液 |
分析 一定量的稀盐酸跟过量锌粉反应时,且不影响生成氢气的总量,可以采用增大稀盐酸浓度、加入铜片、升高温度的方法,以此解答该题.
解答 解:A.加入少量稀NaOH溶液,NaOH和稀盐酸反应生成氯化钠和水,稀盐酸浓度降低、物质的量减小,所以反应速率降低、且生成氢气的总量减少,故A错误;
B.加入硝酸钠,硝酸根离子具有强氧化性,生成NO,不生成氢气,故B错误;
C.加入少量NaHSO4,NaHSO4完全电离生成氢离子,相当于增大氢离子浓度,反应速率加快,且增大生成氢气总量,故C错误;
D.加入少量硫酸铜溶液,锌和铜离子反应生成Cu,Zn、Cu和稀盐酸构成原电池加快反应速率,且生成氢气总量不变,故D正确.
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生的分析能力,温度、浓度、催化剂、反应物接触面积等都影响反应速率,易错选项是C,加入硫酸氢钠相当于加入强酸溶液,题目难度不大.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
19.设NA为阿伏伽德罗常数的值.下列有关叙述错误的是( )
| A. | 80g CuO和Cu2S的混合物中,所含铜原子数为NA | |
| B. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为4NA | |
| C. | 常温下,2L 0.1 mol•L-1FeCl3 溶液与 1L 0.2 mol•L-1FeCl3 溶液所含 Fe3+数目不同 | |
| D. | 100g质量分数为46%的乙醇溶液中含有NA个-OH |
16. 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
3.下列关于物质性质变化的比较中,正确的是( )
| A. | 酸性强弱HIO4<HBrO4<HClO4 | B. | 原子半径大小S>Na>O | ||
| C. | 碱性强弱KOH<NaOH<LiOH | D. | 金属性强弱Na<Mg<Al |
13.下列物质中,既含离子键又含极性共价键的是( )
| A. | NaCl | B. | H2 | C. | H2O | D. | NaOH |
20.下列变化中,未破坏化学键的是( )
| A. | HCl溶于水 | B. | 烧碱受热熔化 | C. | 碘的升华 | D. | CaO溶于水 |
17.已知A是碳元素,B是氧元素,C是钠元素,D是铝元素,下列说法正确的是( )
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 四种元素在同一周期 | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
14.某原电池装置如图所示,下列有关叙述中正确的是( )
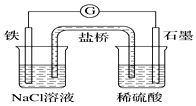

| A. | 石墨电极上发生氧化反应 | B. | 负极反应:2H++2e-═H2↑ | ||
| C. | 电流方向:石墨→铁 | D. | 盐桥中Cl-向右池移动 |