题目内容
1.下列说法正确的是( )| A. |  与丙三醇互为同系物 与丙三醇互为同系物 | |
| B. | 高聚物 与 与 的单体相同 的单体相同 | |
| C. | 按系统命名法,化合物 的名称为2-甲基-3,4-乙基己烷 的名称为2-甲基-3,4-乙基己烷 | |
| D. | 等物质的量的甲烷和乙酸完全燃烧时,耗氧量相等,生成的CO2的量也相等 |
分析 A.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,同系物必须是同一类物质(含有相同且数量相等的官能团);
B.链节中含有酯基结构的高聚物,按酯基中碳氧单键断裂,羰基上加羟基,氧原子上加氢原子即得高聚物单体;根据加聚反应确定单体;
C.根据烷烃命名原则:长、多、近、小、简来解答;
D.根据碳原子守恒.
解答 解:A. 含有6个羟基,丙三醇含有3个羟基,二者结构不同,一定不属于同系物,故A错误;
含有6个羟基,丙三醇含有3个羟基,二者结构不同,一定不属于同系物,故A错误;
B.根据高聚物 的结构可知,合成该缩聚产物的单体为HO-CH(CH=CH2)-COOH;根据
的结构可知,合成该缩聚产物的单体为HO-CH(CH=CH2)-COOH;根据 的结构可知,合成该加聚产物的单体为HO-CH(CH=CH2)-COOH,单体相同,故B正确;
的结构可知,合成该加聚产物的单体为HO-CH(CH=CH2)-COOH,单体相同,故B正确;
C.按系统命名法,化合物 的名称是2-甲基-3,4-二乙基己烷,故C错误;
的名称是2-甲基-3,4-二乙基己烷,故C错误;
D.等物质的量的甲烷和乙酸完全燃烧时,耗氧量相等,生成的CO2的量不相等,前者是后者的一半,故D错误;
故选B.
点评 本题考查了同系物、有机物命名、单体判断等知识,题目难度中等,注意熟练掌握常见有机物命名原则及同系物的判断方法,试题培养了学生的灵活运用能力.

练习册系列答案
相关题目
19.Na2CO3的制取方法及Na2CO3和NaHCO3综合实验探究
Ⅰ.(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图:
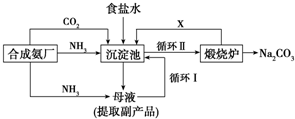
①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是由于CO2在NaCl溶液中的溶解度很小,NH3在水中溶解度较大,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO3-,才能析出NaHCO3晶体.
②写出沉淀池中反应的化学方程式NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:相同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是b、d(填字母序号).
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如表方案并对反应现象做出预测:
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
Ⅰ.(1)我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如图:

①往饱和食盐水中依次通入足量的NH3、CO2(氨碱法),而不先通CO2再通NH3的原因是由于CO2在NaCl溶液中的溶解度很小,NH3在水中溶解度较大,先通入NH3使食盐水呈碱性,能够吸收大量CO2气体,产生较高浓度的HCO3-,才能析出NaHCO3晶体.
②写出沉淀池中反应的化学方程式NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓.
Ⅱ.某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(2)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O.
(3)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液.
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:相同温度下,Na2CO3比NaHCO3易溶于水.
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是b、d(填字母序号).
a.溶液温度下降
b.溶液温度升高
c.滴入酚酞后呈浅红色
d.滴入酚酞后呈红色
(4)同学们将两种固体分别配制成0.5mol•L-1的溶液,设计如表方案并对反应现象做出预测:
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:Ca2++CO32-═CaCO3↓ (离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
12.某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH值升高,则该电解质可能是( )
| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
9.下列图示与对应的叙述相符的是( )
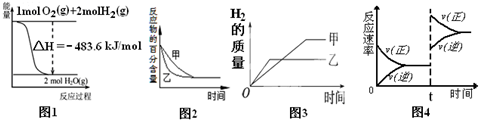

| A. | 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ/mol | |
| B. | 图2表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图3表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图4表示达到化学平衡后,在t时刻增加了反应物的浓度后,正逆反应速率的变化情况 |
16.室温下,用0.100mol/LNaOH溶液滴定20.00mL 0.100mol/L醋酸溶液,滴定曲线如图所示.下列说法不正确的是( )


| A. | N点醋酸与NaOH恰好中和 | |
| B. | O点溶液的pH>1 | |
| C. | M点存在:2c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| D. | W点溶液中水的电离程度最大 |
13.单斜硫和正交硫都是硫的单质,正交硫在一定条件下可以转化为单斜硫并需要吸收能量.已知32g正交硫或单斜硫完全燃烧时放出的热量依次为Q1和Q2,下列说法错误的是( )
| A. | Q1<Q2 | |
| B. | 正交硫不如单斜硫稳定 | |
| C. | 正交硫具有的能量比单斜硫低 | |
| D. | 等质量的单斜硫和正交硫完全燃烧生成的二氧化硫一样多 |
10.新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温下进行,在合成工艺中必须注意( )
| A. | 通入充足的氧气 | B. | 避免与氧气接触 | ||
| C. | 可在氮气气氛中合成 | D. | 通入少量氧气 |
11.下列说法正确的是(NA表示阿伏加德罗常数的数值)( )
| A. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| B. | 2.4g Mg变为Mg2+时失去的电子数目为0.2NA | |
| C. | 1 L 1mol•L-1 CH3COONa溶液中存在NA个CH3COO- | |
| D. | 1 mol Cn H2n+2含有(3n+2)NA个共价键 |