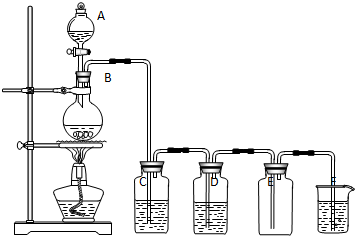
题目内容
11.下列说法正确的是(NA表示阿伏加德罗常数的数值)( )| A. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| B. | 2.4g Mg变为Mg2+时失去的电子数目为0.2NA | |
| C. | 1 L 1mol•L-1 CH3COONa溶液中存在NA个CH3COO- | |
| D. | 1 mol Cn H2n+2含有(3n+2)NA个共价键 |
分析 A.常温常压,Vm≠22.4L/mol;
B.1个镁原子失去2个电子生成+2价镁离子;
C.CH3COO-要发生水解反应;
D.烷烃中碳碳间共用电子对数为碳原子数减去1;碳氢电子对数与H原子个数相同;
解答 解:A.常温常压,Vm≠22.4L/mol,无法计算N2的物质的量,故A错误;
B.2.4g金属镁物质的量为$\frac{2.4g}{24g/mol}$=0.1mol,失去的电子数为0.2NA,故B正确;
C.CH3COO-要发生水解反应生成CH3COOH,1 L 1mol•L-1 CH3COONa溶液中存在CH3COO-小于NA个,故C错误;
D.分子式为CnH2n+2的烃分子中,碳原子数为n,则烷烃中碳碳间共用电子对数为n-1,C-H的对数为2n+2,故1molCnH2n+2的总电子对数为:n-1+2n+2=3n+1,含有(3 n+1)NA个共价键,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 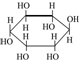 与丙三醇互为同系物 与丙三醇互为同系物 | |
| B. | 高聚物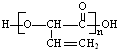 与 与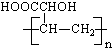 的单体相同 的单体相同 | |
| C. | 按系统命名法,化合物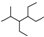 的名称为2-甲基-3,4-乙基己烷 的名称为2-甲基-3,4-乙基己烷 | |
| D. | 等物质的量的甲烷和乙酸完全燃烧时,耗氧量相等,生成的CO2的量也相等 |
2.用碳棒作电极电解下列物质的水溶液,一段时间后,加入适量括号内物质,可使溶液恢复原溶质原浓度的是( )
| A. | NaCl (NaCl ) | B. | MgSO4(MgO) | C. | CuSO4(CuO) | D. | CuCl2(CuCl2) |
19.下列化学用语正确的是( )
| A. | 氟离子的结构示意图: | B. | 氨分子的电子式: | ||
| C. | 丙烯的结构简式:CH3CHCH2 | D. | 乙烯的球棍模型: |
16.下列叙述中正确的是( )
| A. | 化学键只存在于分子之间 | |
| B. | 化学键只存在于离子之间 | |
| C. | 化学键是相邻的原子或离子之间强烈的相互作用 | |
| D. | 化学键是相邻的分子之间强烈的相互作用 |
20.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定温度下,pH=6的纯水中含有OH-的数目为10-6NA | |
| B. | 120 g NaHSO4固体中含有的离子总数为2NA | |
| C. | 标准状况下,22.4 L己烷中所含分子的数目为NA | |
| D. | 100 mL 0.5 mol•L-1的(NH4)2SO4溶液中,NH4+的数目为0.1NA |
 已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题:
已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大.A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E是第四周期d区原子序数最大的元素,F+的最外层电子排布全充满.请回答下列问题: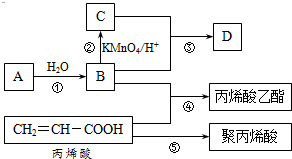 A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略):
A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略): ,C中官能团的名称为羧基.
,C中官能团的名称为羧基. ,加聚反应.
,加聚反应.