题目内容
12.某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH值升高,则该电解质可能是( )| A. | NaOH | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
分析 根据离子的放电顺序判断电解实质,根据电解实质判断溶液中氢离子浓度与氢氧根离子浓度的关系结合题意判断选项.
解答 解:A、电解氢氧化钠溶液时,实际上电解的是水,但溶液中的氢氧根离子的浓度增大,氢离子的浓度减小,所以溶液的pH值增大,故A正确;
B、电解硫酸溶液时,实际上电解的是水,但溶液中氢离子的浓度增大,pH值减小,故B错误;
C、电解硝酸银溶液时,阴极上析出银,阳极上得到氧气,所以溶液中的氢氧根离子的浓度减小,氢离子的浓度增大,溶液的pH值减小,故C错误;
D、电解硫酸钠溶液时,实际上电解的是水,所以溶液中氢离子和氢氧根离子的相对浓度不变,只是硫酸钠的浓度增大,故pH值不变,故D错误;
故选A.
点评 本题考查了电解原理,随着电解的进行判断溶液pH值的变化,首先要知道离子的放电顺序、电解的实质,只有明白这些知识点才能正确解答.

练习册系列答案
相关题目
10.下列说法中正确的是( )
| A. | 化学反应不一定都有能量变化 | |
| B. | 增大反应物浓度,活化分子百分数增大,化学反应速率一定增大 | |
| C. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| D. | 一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率 |
11.(1)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如表.
则:①该反应的△H<0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.求CO的平衡转化率=60%.
(2)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式M++H2O?MOH+H+
(3)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的C(H+)水 之比为1:10:100:1.
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中c(H+)=6×10-3mol•L-1
(5)在温度t℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L.在此温度下5×10-5mol/LBa(OH)2溶液的pH=7.
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.求CO的平衡转化率=60%.
(2)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式M++H2O?MOH+H+
(3)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的C(H+)水 之比为1:10:100:1.
(4)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1mol•L-1 HF溶液中c(H+)=6×10-3mol•L-1
(5)在温度t℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L.在此温度下5×10-5mol/LBa(OH)2溶液的pH=7.
8.下列反应属于离子反应的是( )
| A. | H2和O2反应生成水 | B. | 锌片投入稀硫酸中 | ||
| C. | KMnO4加热分解制取O2 | D. | NH3遇HCl气体生成白烟(NH4Cl) |
7.用石墨作电极电解200mL一定浓度的CuSO4溶液,一段时间后停止电解,然后向电解后的溶液中加入0.1mol Cu2(OH)2CO3,可使溶液完全恢复至电解前的浓度和体积,则电解过程中电路通过电子的物质的量是( )
| A. | 0.4 mol | B. | 0.6 mol | C. | 0.8 mol | D. | 1.0 mol |
4.下列说法中正确的是( )
| A. | 煤的气化和液化是物理变化 | |
| B. | 煤的干馏是化学变化 | |
| C. | 石油裂解的目的是为了提高轻质油的产量和质量 | |
| D. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 |
1.下列说法正确的是( )
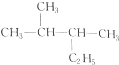
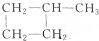
| A. |  与丙三醇互为同系物 与丙三醇互为同系物 | |
| B. | 高聚物 与 与 的单体相同 的单体相同 | |
| C. | 按系统命名法,化合物 的名称为2-甲基-3,4-乙基己烷 的名称为2-甲基-3,4-乙基己烷 | |
| D. | 等物质的量的甲烷和乙酸完全燃烧时,耗氧量相等,生成的CO2的量也相等 |
2.用碳棒作电极电解下列物质的水溶液,一段时间后,加入适量括号内物质,可使溶液恢复原溶质原浓度的是( )
| A. | NaCl (NaCl ) | B. | MgSO4(MgO) | C. | CuSO4(CuO) | D. | CuCl2(CuCl2) |
 与
与
 与
与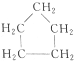
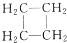 与
与