题目内容
18.生产、生活中处处有化学,下列有关说法正确的是( )| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,PH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 | |
| D. | 人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代,目前,全球已主要处于多能源时代 |
分析 A.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;
B.亚硫酸不稳定易被氧化生成硫酸;
C.盐与水不发生化学反应;
D.目前,全球已主要使用化石能源.
解答 解:A.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,因此工业上生产玻璃、水泥、漂白粉,均需要用石灰石为原料,故A正确;
B.酸雨中的亚硫酸不稳定易被氧化生成硫酸,亚硫酸是弱电解质、硫酸是强电解质,从而增强溶液的酸性,与二氧化碳无关,故B错误;
C.盐溶液凝固点比较低,撒盐是为化开路面上的冰,便于交通,故C错误;
D.人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代,目前,全球已主要处于化石能源,故D错误;
故选:A.
点评 本题考查了生活、生产中的化学知识,熟悉工业生产玻璃、水泥、漂白粉用到的原料、酸雨的成因、能源的分类是解题关键,题目难度不大.

练习册系列答案
相关题目
8.下列物质属于纯净物的是( )
| A. | 铝热剂 | B. | 生铁 | C. | 绿矾 | D. | 钢 |
6.下列反应原理正确且化学用语书写也正确的是( )
| A. | 泡沫灭火器的工作原理是:2Al3++3CO32-+3H2O═2Al(0H)3↓+3CO2↑ | |
| B. | 石墨为电极电解 FeCl 2溶液,阳极电极反应式为:2Cl--2e-═Cl2↑ | |
| C. | 实验室中加热熟石灰和氯化铵制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NH4HCO3溶液:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
13.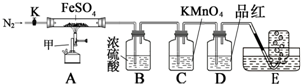 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m gFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)仪器甲的名称是酒精喷灯;
(2)B中浓硫酸的作用吸收分解产生的SO3;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是将装置内残留的气体排入吸收装置2完全吸收,同时防止发生倒吸;
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
①滴定至终点的现象溶液由紫红色变为无色且半分钟不恢复成紫红色;
②FeSO4分解的化学方程式为8FeSO4 $\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(6)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取m gFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K.加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的气体,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃.待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末.请回答下列问题:
(1)仪器甲的名称是酒精喷灯;
(2)B中浓硫酸的作用吸收分解产生的SO3;
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化.写出C中发生反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)FeSO4完全分解后,还需要通入一段时间N2的原因是将装置内残留的气体排入吸收装置2完全吸收,同时防止发生倒吸;
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
I、称量B装置在实验前后增重0.80g;
II、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
III、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mol/L标准H2C2O4溶液滴定至终点;
IV、重复实验3次,记录数据如表
| 实验 | 滴定管开始读数 | 滴定终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
②FeSO4分解的化学方程式为8FeSO4 $\frac{\underline{\;高温\;}}{\;}$4Fe2O3+2SO3↑+6SO2↑+O2↑;
(6)请设计一个实验来检验A中的FeSO4是否完全分解将废液后的固体转移到小烧杯中,加入少量水搅拌过滤,取少量滤液于试管中,加入几滴K3[Fe(CN)6]溶液,若产生特征蓝色沉淀,说明硫酸亚铁未全部分解,反之则分解完全.
10.下列各选项均有X、Y两种物质,将X缓缓滴入(通入)Y溶液中,无论X是否过量,均能用同一离子方程式表示的是( )
| A. | X-二氧化硫,Y-氢氧化钠溶液 | B. | X-氢氧化钠溶液,Y-硫酸铝溶液 | ||
| C. | X-二氧化碳,Y-偏铝酸钠溶液 | D. | X-二氧化碳,Y-饱和碳酸钠溶液 |
7.化学是你,化学是我,化学深入我们生活,下列说法正确的是( )
| A. | 塑料、合成橡胶和合成纤维,都主要是以石油、煤、天然气为原料生产的 | |
| B. | 煤的综合利用包括煤作燃料、煤的干馏、煤的液化和气化 | |
| C. | 石油裂化的目的是使直链烃转化为芳香烃 | |
| D. | 包装用材料聚乙烯和聚氯乙烯都属于烃 |


 +(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).
+(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).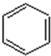 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$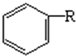
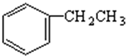 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$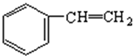 +H2
+H2 .
. .(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)
.(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)