题目内容
18.完成下列反应的离子方程式(1)用盐酸淸洗盛放过石灰水的试剂瓶H++OH-=H2O
(2)实验室用锌粒制氢气2H++Zn=Zn2++H2↑
(3)向硫酸氢钠溶液中逐滴加入氢氧化钡溶液至中性H++OH-═H2O,向以上溶液中继续滴加氢氧化钡SO42-+Ba2+=BaSO4↓.
分析 (1)二者反应生成氯化钙和水;
(2)锌与稀硫酸反应生成硫酸锌和氢气;
(3)向硫酸氢钠溶液中逐滴加入氢氧化钠溶液呈中性,硫酸氢钠与氢氧化钠按照物质的量1:1反应;在所述的中性溶液中继续加入氢氧化钡溶液,反应生成硫酸钡沉淀.
解答 解:(1)二者反应生成氯化钙和水,离子方程式:H++OH-=H2O;
故答案为:H++OH-=H2O;
(2)锌与稀硫酸反应生成硫酸锌和氢气,离子方程式:2H++Zn=Zn2++H2↑;
故答案为:2H++Zn=Zn2++H2↑;
(3)向硫酸氢钠溶液中逐滴加入氢氧化钠溶液呈中性,反应生成硫酸钠和水,反应的离子方程式为:H++OH-═H2O,在所述的中性溶液中继续加入氢氧化钡溶液,钡离子与硫酸根离子反应生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,
故答案为:H++OH-═H2O;SO42-+Ba2+=BaSO4↓.
点评 本题考查离子方程式的书写,题目难度中等,试题题量稍大,注意掌握离子方程式的书写原则,明确反应物过量情况对生成物的影响,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.两气体A和B的摩尔质量之比为2:1,则它们在同温、同压、同体积时的分子个数比应为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 4:1 |
7.下列说法都正确的一组是( )
①氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
②等体积、等密度的CO和N2含有相同分子数
③浓度均为0.1mol/L的盐酸和氢氧化钠溶液等体积混合,混合后溶液导电性不变
④1mol某气体的体积约为22.4L,该气体所处的状况一定是标准状况
⑤胶体可以稳定存在的原因是胶体带电.
①氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
②等体积、等密度的CO和N2含有相同分子数
③浓度均为0.1mol/L的盐酸和氢氧化钠溶液等体积混合,混合后溶液导电性不变
④1mol某气体的体积约为22.4L,该气体所处的状况一定是标准状况
⑤胶体可以稳定存在的原因是胶体带电.
| A. | ①②③ | B. | 仅② | C. | ②④⑤ | D. | ②⑤ |
8.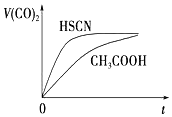 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.
(2)物质的量浓度均为0.1mol/L的六种溶液:
a.CH3COONa、b.Na2CO3、c.NaClO、d.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为b>f>c>d>a>e(用编号填写).
(3)25℃时,将20mL0.1mol•L-1CH3COOH溶液和20mL0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示.反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).$\frac{c(C{N}^{-})}{c(HCN)}$=$\frac{6.2×1{0}^{-10}}{1{0}^{-8}}$ (填代入数据后的计算式,不必算出具体数值).
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
(6)25C时,0.18mol/L醋酸钠溶液的PH约为9.
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.
(2)物质的量浓度均为0.1mol/L的六种溶液:
a.CH3COONa、b.Na2CO3、c.NaClO、d.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为b>f>c>d>a>e(用编号填写).
(3)25℃时,将20mL0.1mol•L-1CH3COOH溶液和20mL0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示.反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=10-6-10-8mol/L(填代入数据后的计算式,不必算出具体数值).$\frac{c(C{N}^{-})}{c(HCN)}$=$\frac{6.2×1{0}^{-10}}{1{0}^{-8}}$ (填代入数据后的计算式,不必算出具体数值).
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
(6)25C时,0.18mol/L醋酸钠溶液的PH约为9.
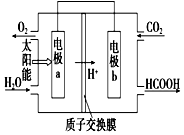 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.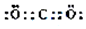 ,
,