题目内容
3.工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式
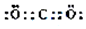 ,
,属于弱酸的电离方程式HF?H++F-.
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是ac(选填编号).
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢.
分析 (1)先判断反应物与生成物中的非极性分子,再由最外层电子来分析电子式,判断出弱酸,再书写电离方程式,注意用可逆号;
(2)根据反应物中的元素可知,氧、氟元素位置相邻,则利用非金属性强弱的判断方法来解答.
解答 解:(1)由反应的反应物和生成物中的物质可知,只有二氧化碳是非极性分子,由碳最外层4个电子,氧最外层6个电子,则二氧化碳的电子式为 ,反应中的物质只有HF为弱酸,弱酸在电离时存在电离平衡,则电离方程式为HF?H++F-,故答案为:
,反应中的物质只有HF为弱酸,弱酸在电离时存在电离平衡,则电离方程式为HF?H++F-,故答案为: ;HF?H++F-;
;HF?H++F-;
(2)该反应中的物质含有的元素有Al、O、H、F、Na、C,只有O、F元素相邻,因F的非金属性最强,则没有正价,也就没有最高价氧化物对应水化物,它们也不与酸反应,但可以利用气态氢化物的稳定性和单质与氢气反应的难易来判断O、F非金属性的强弱,故答案为:ac.
点评 本题考查的知识点较多,学生应注重归纳非金属性强弱的比较方法、物质之间的反应、化学用语的使用、晶体类型的判断方法等来解答即可.

练习册系列答案
相关题目
14.下列离子反应方程式正确的是( )
| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
8.现有常温下四份等体积的酸或碱溶液:①0.01mol/L CH3COOH;②0.01mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液.以下有关说法正确的是( )
| A. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>①>② | |
| B. | 将①、④等体积混合,则混合液的PH为7 | |
| C. | 四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ | |
| D. | 将②加入③至恰好完全反应,则消耗体积为③>② |
15.下列反应中属于氧化还原反应的是( )
| A. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O | B. | Na2O+H2O═2NaOH | ||
| C. | Na2CO3+H2SO4═Na2SO4+CO2↑+H2O | D. | KClO3+6HCl (浓)═KCl+3H2O+3Cl2 |