题目内容
19.有机物种类繁多,有下列8种有机物,有关说法不正确的是( )①C5H12 ②C3H6 ③CH2=CH-CH=CH2④
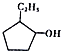 ⑤
⑤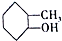 ⑥
⑥ ⑦
⑦ ⑧
⑧
| A. | ①和⑧是同系物 | B. | ②和③不是同系物 | ||
| C. | ④和⑤是同分异构体 | D. | ⑥和⑦是同分异构体 |
分析 有机化合物中具有同一通式、组成上相差一个或多个CH2原子团、在结构与性质上相似的化合物互为同系物;
具有相同分子式而结构不同的化合物互为同分异构体;
根据以上概念进行判断.
解答 解:A.①和⑧都是烷烃,碳原子数不同,是同系物,故A正确;
B.②C3H6为丙烯或环丙烷和③CH2=CH-CH=CH2结构不相似,不为同系物,故B正确;
C.④ ⑤
⑤ 分子式相同结构不同,为同分异构体,故C正确;
分子式相同结构不同,为同分异构体,故C正确;
D.⑥ ⑦
⑦ 分子式不同,不为同分异构体,故D错误.
分子式不同,不为同分异构体,故D错误.
故选D.
点评 本题考查了同系物、同分异构体的判断,题目难度不大,注意掌握同系物、同分异构体的概念及判断方法,明确具有相同的相对分子质量的化合物不一定具有相同的分子式.

练习册系列答案
相关题目
9.某同学对一些元素进行排列(表中数字为原子序数),根据现行的周期表,下列排列你认为合理的是
)
)
| A. |
| B. |
| C. |
| D. |
|
10.根据下面的四个装置图判断下列说法不正确的是( )
| A. | 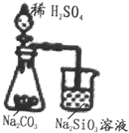 可以用业证明非金属性的相对强弱S>C>Si 可以用业证明非金属性的相对强弱S>C>Si | |
| B. | 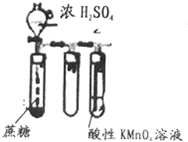 可以用来检验是否有还原性气体生成 可以用来检验是否有还原性气体生成 | |
| C. | 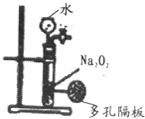 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 该装置可以用业制备少量氧气,且可以控制反应的进行及快慢 | |
| D. |  滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 滴定过程中褪色速度由慢到快又减慢,达到终点时,溶液的颜色从无色突变为浅紫红色 |
7.下列离子在溶液中能大量共存的是( )
| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
14.化学深入我们的生活,下列相关说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | 生活中常用的淀粉、蔗糖、葡萄糖的组成元素相同 |
4.下列各组有机物,不论按何种比例混合,只要混合物的总质量一定,完全燃烧后生成水的总质量也一定的是( )
| A. | 甲醛、乙酸 | B. | 乙醇、乙二醇 | C. | 甲烷、丙炔 | D. | 苯、乙烯 |
11.有碳原子数相同的烯烃、炔烃混合气xL,完全燃烧后生成yLCO2和zL水蒸气(温度、压强和原混合气相同),若x:y:z=3:6:4,则下列叙述正确的是( )
| A. | 原混合气为体积比为1:2的乙烯和乙炔 | |
| B. | 原混合气为体积比为1:1的丙烯和丙炔 | |
| C. | 原混合气为任意体积比的乙烯和乙炔 | |
| D. | 原混合气为体积比为1:2的乙烯和丙炔 |
8. 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
(1)肼是火箭的高能燃料,该物质燃烧时生成水蒸气和氮气,已知某些化学键能如下:
①N2H4中氮元素的化合价为-2.
②气态N2H4在氧气中燃烧的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=一591kJ/mol.
(2)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液,该反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O.
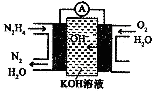
(3)肼燃料电池原理如图所示,左边电极上发生反应的电极反应式为:N2H4-4e-+4OH-=N2+4H2O.
(4)盐酸肼(N2H6Cl2)是一种化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4 Cl类似,但分步水解.
①写出盐酸肼第一步水解的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的关系为B (填序号).
A.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
B.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
C. c(N2H62+)+c([N2H5•H2O+])+c(H+)=c(Cl-)+c(OH-)
(5〕常温下,将0.2mol/L盐酸与0.2mol/L肼的溶液等体积混合(忽略混合后溶液体积变化〕.若测定混合液的pH=6,混合液中水电离出的H+与0.1mol/L盐酸中水电离出的H+浓度之比为107:1.
 肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、化工原料及燃料电池等方面.请回答下列问题:(1)肼是火箭的高能燃料,该物质燃烧时生成水蒸气和氮气,已知某些化学键能如下:
| 化学键 | O-H | N-N | N-H | O=O | N═N |
| 键能/KJ•mol-1 | 467 | 160 | 391 | 498 | 945 |
②气态N2H4在氧气中燃烧的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=一591kJ/mol.
(2)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液,该反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O.
(3)肼燃料电池原理如图所示,左边电极上发生反应的电极反应式为:N2H4-4e-+4OH-=N2+4H2O.
(4)盐酸肼(N2H6Cl2)是一种化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4 Cl类似,但分步水解.
①写出盐酸肼第一步水解的离子方程式N2H62++H2O═[N2H5•H2O]++H+.
②盐酸肼水溶液中离子浓度的关系为B (填序号).
A.c(Cl-)>c([N2H5•H2O+])>c(H+)>c(OH-)
B.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
C. c(N2H62+)+c([N2H5•H2O+])+c(H+)=c(Cl-)+c(OH-)
(5〕常温下,将0.2mol/L盐酸与0.2mol/L肼的溶液等体积混合(忽略混合后溶液体积变化〕.若测定混合液的pH=6,混合液中水电离出的H+与0.1mol/L盐酸中水电离出的H+浓度之比为107:1.
9.食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
表中数据:t1<t2(填“>”、“<”或“=”);表中V2=40mL.
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol•L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol•L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |