题目内容
7.下列离子在溶液中能大量共存的是( )| A. | H+、I-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
分析 A.硝酸根离子在酸性条件下能够氧化碘离子,硅酸根离子与氢离子反应;
B.银离子与氯离子、硫酸根离子反应;
C.四种离子之间不发生反应,能够共存;
D.铵根离子、碳酸氢根离子与氢氧根离子反应.
解答 解:A.H+、I-、NO3-之间发生氧化还原反应,H+、SiO32-之间反应生成硅酸,在溶液中不能大量共存,故A错误;
B.Ag+与Cl-、SO42-之间反应生成沉淀,在溶液中不能大量共存,故B错误;
C.K+、SO42-、Cu2+、NO3-之间不发生反应,在溶液中不能大量共存,故C正确;
D.OH-与NH4+、HCO3-发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
18.下列叙述中.不正确的是( )
| A. | 在平衡体系PCl3(g)?PCl3+Cl2(g)中加入一定量的${\;}_{\;}^{37}$Cl,达到平衡后”37Cl仅存在于五氯化鱗和氯气分子里,不可能存在于三氯化磷分子 | |
| B. | CH3C00H与H180-CH2CH3;发生酯化反应化是可逆反应,达到平衡后${\;}_{\;}^{18}$0仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 | |
| C. | CH2Br2没有同分异构体的事实证明了甲烷分子是碳原子为中心的正四面体结构 | |
| D. | 在氧气中完全燃烧后生成物只有C02和H2O的有机物不一定是烃 |
2.${\;}_{92}^{235}$U是制造原子弹和核发电的重要工业原料,关于铀元素的下列说法正确的是( )
| A. | ${\;}_{\;}^{235}$U的原子核外有143个电子 | B. | ${\;}_{\;}^{235}$U、${\;}_{\;}^{238}$U是同一种核素 | ||
| C. | ${\;}_{\;}^{235}$U一个原子中有92个中子 | D. | ${\;}_{\;}^{235}$U和${\;}_{\;}^{238}$U互为同位素 |
19.有机物种类繁多,有下列8种有机物,有关说法不正确的是( )
①C5H12 ②C3H6 ③CH2=CH-CH=CH2④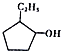 ⑤
⑤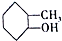 ⑥
⑥ ⑦
⑦ ⑧
⑧
①C5H12 ②C3H6 ③CH2=CH-CH=CH2④
 ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧
| A. | ①和⑧是同系物 | B. | ②和③不是同系物 | ||
| C. | ④和⑤是同分异构体 | D. | ⑥和⑦是同分异构体 |
16.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4的工艺流程如下:
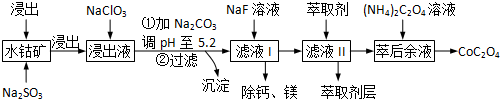
己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原.
(2)NaClO3可将Fe2+氧化为Fe3+离子.可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3.实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72L(标准状况下).
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示.使用萃取剂最适宜的pH是B(填选项序号).
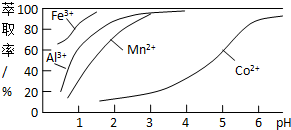
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时(填颜色变化),共用去高锰酸钾溶液VmL,计算草酸钴样品的纯度为36.75cv/m%.

己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3可将Fe2+氧化为Fe3+离子.可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3.实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72L(标准状况下).
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示.使用萃取剂最适宜的pH是B(填选项序号).

A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时(填颜色变化),共用去高锰酸钾溶液VmL,计算草酸钴样品的纯度为36.75cv/m%.
17.下列物质性质的比较,不能用元素周期律解释的是( )
| A. | 稳定性:H2O>NH3 | B. | 碱性:NaOH>Al(OH)3 | ||
| C. | 氧化性:F2>Cl2 | D. | 酸性:CH3COOH>H2CO3 |
 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: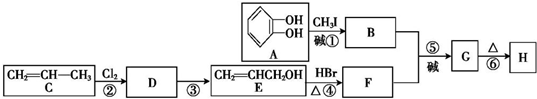
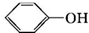 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$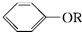 +HX(X代表卤素原子);
+HX(X代表卤素原子);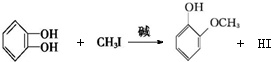 .
.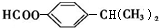 .
.