题目内容
8.某铝合金(硬铝)中含有铝、镁、铜、硅等成分,为了测定该合金中铝的质量分数,实验流程如下: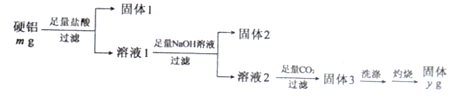
请回答下列有关问题:
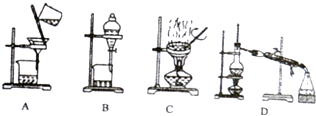
(1)过滤操作的装置为A(填序号).
(2)固体2的化学式为Mg(OH)2.
(3)工业制取固体1中非金属单质的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
(4)生成溶液2中溶质的离子方程式为Al3++4OH-=AlO2-+2H2O.
(5)验证两性氢氧化物固体3的洗涤是否干净的实验为取洗涤液少许于试管中,加入硝酸银溶液,若无白色沉淀生成,证明洗涤干净.
(6)合金中铝的质量分数为$\frac{9y}{17m}$×100%.
分析 由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体1为Cu、Si,溶液中含Al3+、Mg2+,②加足量的NaOH,过滤得到的沉淀为固体2为Mg(OH)2,溶液中主要含AlO2-,③通足量的二氧化碳,反应生成固体3为Al(OH)3,洗涤灼烧得到yg固体为Al2O3,据此分析,
(1)过滤是固体和液体分离的实验基本操作,在过滤器中过滤,用到的仪器有烧杯、玻璃棒、漏斗等;
(2)分析可知固体2为氢氧化镁沉淀;
(3)工业制取固体1中非金属单质为硅,工业制备硅是利用二氧化硅和碳高温下反应生成;
(4)生成溶液2中溶质为偏铝酸钠,反应是氯化铝和过量的氢氧化钠溶液反应生成;
(5)溶液中氢氧化铝过滤后洗涤液中含有氯离子,利用最后一次洗涤液中加入硝酸银溶液观察是否生成白色沉淀设计检验;
(6)依据铝元素守恒计算铝的质量分数;
解答 解:由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体1为Cu、Si,溶液中含Al3+、Mg2+,②加足量的NaOH,过滤得到的沉淀为固体2为Mg(OH)2,溶液中主要含AlO2-,③通足量的二氧化碳,反应生成固体3为Al(OH)3,洗涤灼烧得到yg固体为Al2O3,
(1)过滤是固体和液体分离的实验基本操作,在过滤器中过滤,用到的仪器有烧杯、玻璃棒、漏斗等,装置中A为过滤装置,
故答案为:A;
(2)固体2为氢氧化镁沉淀,化学式为Mg(OH)2,
故答案为:Mg(OH)2;
(3)工业制取固体1中非金属单质为硅,工业制备硅是利用二氧化硅和碳高温下反应生成,反应的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
(4)生成溶液2中溶质为四羟基合铝酸钠,反应是氯化铝和过量的氢氧化钠溶液反应生成,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(5)溶液中氢氧化铝过滤后洗涤液中含有氯离子,利用最后一次洗涤液中加入硝酸银溶液观察是否生成白色沉淀设计检验,步骤为:取洗涤液少许于试管中,加入硝酸银溶液,若无白色沉淀生成,证明洗涤干净,
故答案为:取洗涤液少许于试管中,加入硝酸银溶液,若无白色沉淀生成,证明洗涤干净;
(6)流程中得到氧化铝沉淀为yg,结合铝元素守恒计算得到铝的质量分数=$\frac{\frac{yg}{102g/mol}×2×27g/mol}{mg}$×100%=$\frac{9y}{17m}$×100%,
故答案为:$\frac{9y}{17m}$×100%,
点评 本题考查了物质组成的实验测定,题目难度中等,明确实验流程及化学实验基本操作方法为解题关键,试题知识点较多、综合性较强,充分考查学生灵活应用基础知识的能力,是一道质量较好的题目.

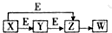 如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )
如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )| A. | W可能是硫酸 | B. | Y不可能是Mg | C. | X可能是钠 | D. | Z可能是CO2 |
| A. | 高纯度的硅单质广泛用于制造光导纤维 | |
| B. | SiO2是酸性氧化物,不溶于任何酸 | |
| C. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| D. | 石灰石是生产玻璃和水泥的主要原料 |

| A. | 加热NaHCO3制CO2 | B. | 用Cu与稀硝酸反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用锌与稀硫酸反应制H2 |
| A. | 过氧化钠常用于远途运输鱼苗的供氧 | |
| B. | 侯式制碱法的工艺过程中应用了物质的溶解性差异 | |
| C. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| D. | 使用含有钙离子浓度较大的地下水洗衣服,肥皂的去污能力减弱 |
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 航海船船底四周镶嵌锌块保护船体,利用的是牺牲阳极保护法 | |
| C. | 用铝制铆钉连接铁板,铝钉易被腐蚀 | |
| D. | 原电池中电子由正扱流入负极 |
| A. | 28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的质子数为10NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,转移电子数为NA |
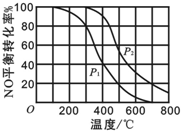 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示. 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-