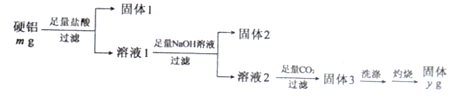
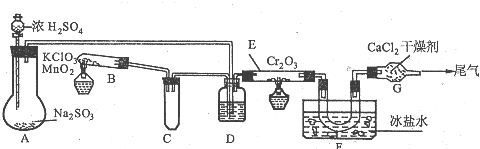
题目内容
13.若生产者固定的太阳能等于消费者呼吸散失的能量,则该自然生态系统处于稳态化学与生活、生产联系紧密,下列说法不正确的是( )| A. | 过氧化钠常用于远途运输鱼苗的供氧 | |
| B. | 侯式制碱法的工艺过程中应用了物质的溶解性差异 | |
| C. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| D. | 使用含有钙离子浓度较大的地下水洗衣服,肥皂的去污能力减弱 |
分析 A、过氧化钠与水反应生成氧气;
B、侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出;
C、具有吸水性的植物纤维无毒;
D、可生成高级脂肪酸钙沉淀.
解答 解;A、过氧化钙常用于远途运输鱼苗的供氧,故A错误;
B、侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,发生以下反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,碳酸氢钠不稳定受热分解,所以应用了溶解度和不稳定性,故B正确;
C、具有吸水性的植物纤维无毒,则可用作食品干燥剂,故C正确;
D、含钙离子浓度较大的地下水与高级脂肪酸钠反应可生成高级脂肪酸钙沉淀,去污能力减弱,故D正确.
故选A.
点评 本题考查物质的性质及食品干燥剂,为高频考点,把握物质的性质、化学与生活的关系为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

练习册系列答案
相关题目
3.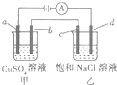 如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a,b,c均为石墨电极,d为碳钢电极,通电电解一段时间,假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯中b电极反应式为:Cu2++2e-═Cu | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为0.56L(标准状况) |
4.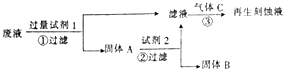 如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
 如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )| A. | 试剂1可以是铁也可以是铜 | |
| B. | 试剂2可以是盐酸也可以是硫酸 | |
| C. | 气体C为Cl2,不能用H2O2替换 | |
| D. | 步骤①②③中发生的反应均为氧化还原反应 |
1.下列关于Na2CO3和NaHCO3的说法中正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 澄清的石灰水能与Na2CO3反应,不与NaHCO3反应 | |
| D. | 等物质的量的Na2CO3和NaHCO3与等浓度足量的盐酸反应,消耗盐酸体积之比为2:1 |
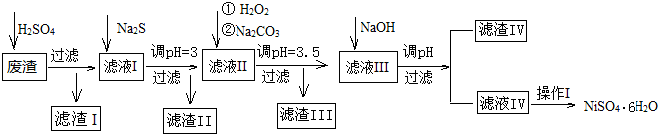
18.金属镍在电池和电镀等工业上具有广泛的用途,可镍也具有很强的毒性,若不进行回收处理,将对环境造成很大的影响,以下是以电镀废渣为原料获得NiSO4•6H2O的过程,已知,废渣中除含金属镍外,主要含有:Cu、Zn、Fe、Mg等元素的化合物.
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
(1)往废渣中加H2SO4酸浸,提高酸浸效率的方法有搅拌、升温、适当增加硫酸浓度、废渣粉碎等(至少写出2点)
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作Ⅰ包括以下过程:冷却、结晶、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用酒精洗涤,目的是既能洗涤沉淀表面残余的溶液又有利晶体的干燥并减少NiSO4﹒6H2O晶体的损失.干燥有低温干燥和高温干燥,能否用高温干燥否,理由是温度过高会使NiSO4﹒6H2O晶体失去部分或全部结晶水.
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=2.5×1013.{已知:25℃时,KSP[Mg(OH)2]=5.0×10-14;KSP[Al(OH)3]=2.0×10-33}.

部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)操作Ⅰ包括以下过程:冷却、结晶、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用酒精洗涤,目的是既能洗涤沉淀表面残余的溶液又有利晶体的干燥并减少NiSO4﹒6H2O晶体的损失.干燥有低温干燥和高温干燥,能否用高温干燥否,理由是温度过高会使NiSO4﹒6H2O晶体失去部分或全部结晶水.
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=2.5×1013.{已知:25℃时,KSP[Mg(OH)2]=5.0×10-14;KSP[Al(OH)3]=2.0×10-33}.
5.含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1molAg,下列结论错误的是( )
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1molFe可还原2molFe3+ |
2.下列实验操作或装置符合实验要求的是( )
| A. |  构成铜锌原电池 | B. |  电解制氢气、氯气 | ||
| C. |  中和反应热量测定 | D. |  酸碱中和滴定 |