题目内容
7.硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题.(1)H2S和CO混合加热可制得羰基硫(COS).羰基硫可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.反应方程式为:CO(g)+H2S(g)?COS(g)+H2(g)
①羰基硫的电子式为
 其含有的共价键类型是极性共价键.
其含有的共价键类型是极性共价键.②下列能说明碳与硫两元素非金属性相对强弱的是ac.
a.相同条件下水溶液的pH:NaHCO3>NaHSO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O.
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图1所示(忽略溶液体积的变化、H2S的挥发).
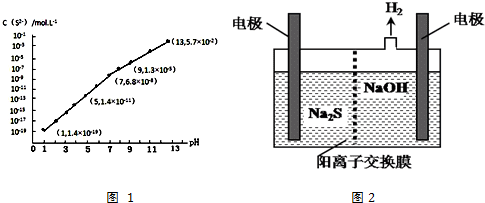
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13].
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图2所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:
S2--2e-=S↓ (n-1)S+S2-?Sn2-
①写出电解时阴极的电极反应式:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-).
②Na2S溶液中离子浓度由大到小顺序:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
分析 (1)①羰基硫与二氧化碳是等电子体,其结构相似,根据二氧化碳电子式书写羰基硫电子式;不同非金属元素之间易形成极性键;
②元素的非金属性越强,其单质的氧化性越强,其单质与氢气化合越容易,其氢化物越稳定,其最高价氧化物的水化物酸性越强;
(2)该反应中S元素化合价由-2价变为0价、+6价,Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式;
(3)①任何电解质溶液中都存在物料守恒,根据物料守恒计算;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;
(4)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气;
②硫离子存在两步水解,且第一步水解程度远远大于第二步,两步水解都生成OH-,溶液呈碱性,溶液中氢离子浓度很小.
解答 解:(1)①羰基硫与二氧化碳是等电子体,其结构相似,根据二氧化碳电子式书写羰基硫电子式为 ;不同非金属元素之间易形成极性键,所以该分子中存在极性键,故答案为:
;不同非金属元素之间易形成极性键,所以该分子中存在极性键,故答案为: ;极性;
;极性;
②a.相同条件下水溶液的pH:NaHCO3>NaHSO4,可知硫酸酸性大于碳酸,则非金属性S>C,故选;
b.亚硫酸不是最高价含氧酸,则酸性:H2SO3>H2CO3,不能比较非金属性,故不选;
c.S与H2的化合比C与H2的化合更容易,则非金属性S>C,故选;
故答案为:ac;
(2)该反应中S元素化合价由-2价变为0价、+6价,Mn元素化合价由+7价变为+2价,根据转移电子守恒、原子守恒配平方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案为:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{{K}_{sp}(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5;
(4)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);
②硫离子存在两步水解,且第一步水解程度远远大于第二步,两步水解都生成OH-,溶液呈碱性,溶液中氢离子浓度很小,所以离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
点评 本题考查较综合,涉及离子浓度大小比较、原电池和电解池原理、氧化还原反应、非金属性强弱比较等知识点,为高频考点,明确化学反应原理、元素化合物性质是解本题关键,注意非金属性强弱比较中只有其最高价氧化物的水化物酸性强弱才能比较得出正确结论,其一般的酸酸性强弱不能比较得出正确结论,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c (CH3COO-)>c(H+)>c(OH-) | |
| B. | 等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F-)+c(HF) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | c(NH4+)相等的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2三份溶液,其c依次增大 |
| A. | 60gSiO2晶体有σ键4NA | |
| B. | 在标准状况下,2.24 LSO3中含有的氧原子数为0.3NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 标准状况下,2.24LCl2通入足量H2O溶液中转移的电子数为0.1NA |
| A. | 氟化铵的电子式: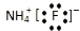 | |
| B. | 原子最外层只有1个电子的元素一定是金属元素 | |
| C. | 离子结构示意图: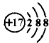 ,可以表示35Cl-,也可以表示37Cl- ,可以表示35Cl-,也可以表示37Cl- | |
| D. | 1mol CH4与1mol NH4+所含质子数相等 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)②和⑧形成的化合物灼烧时焰色为紫色;
(3)元素⑦的氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,用元素⑧的单质制备漂白液的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(4)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+;
(5)写出①和⑦形成的稳定化合物的电子式
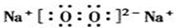 ;
;(6)用电子式表示⑥和⑦形成化合物的形成过程
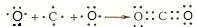 .
. | A. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| B. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
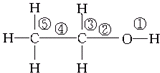
关于乙醇在各种不同反应中断裂键的说法不正确的是( )
| A. | 与金属钠反应,键①断裂 | |
| B. | 在Ag或Cu催化作用下和O2反应,键②和键③断裂 | |
| C. | 和浓硫酸共热,在170℃时发生消去反应时键②和⑤断裂 | |
| D. | 乙醇和乙酸在浓硫酸作用下加热时发生反应,键①断裂 |
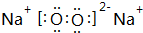 ,用电子式表示该化合物的形成过程
,用电子式表示该化合物的形成过程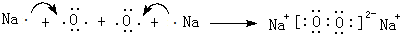 .
.