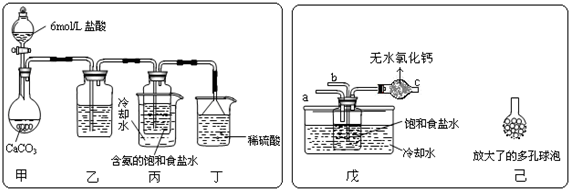
题目内容
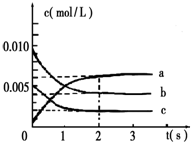
8.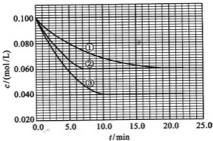 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②使用催化剂; ③升温;
(2)实验②平衡时B的转化率为40%;实验③平衡时C的浓度为0.06mol/L;
(3)该反应的△H大于0,判断其理由是升温,A的浓度减少,平衡向正反应方向移动;
(4)该反应进行到4.0min时的平均反应速度率:
实验②:vB=0.011mol/(L.min).
分析 (1)①②比较,平衡状态相同,②中反应速率大;①③比较,在溶液中的反应③中正向进行程度大,反应速率大;
(2)②中平衡时A的浓度为0.060mol/L,转化的A为0.1mol/L-0.060mol/L=0.04mol/L,则转化的B为0.08mol/L;③中衡时A的浓度为0.040mol/L,转化的A为0.1mol/L-0.040mol/L=0.06mol/L;
(3)由①③可知,升高温度,平衡正向移动;
(4)结合v=$\frac{△c}{△t}$计算.
解答 解:(1)①②比较,平衡状态相同,②中反应速率大;①③比较,在溶液中的反应③中正向进行程度大,反应速率大,则②改变的条件为使用催化剂,③改变的条件为升温,
故答案为:使用催化剂;升温;
(2)②中平衡时A的浓度为0.060mol/L,转化的A为0.1mol/L-0.060mol/L=0.04mol/L,则转化的B为0.08mol/L,B的转化率为$\frac{0.08}{0.2}$×100%=40%;③中衡时A的浓度为0.040mol/L,转化的A为0.1mol/L-0.040mol/L=0.06mol/L,由A+2B?C可知③平衡时C的浓度为0.06mol/L,
故答案为:40%;0.06mol/L;
(3)由①③可知,升高温度,A的浓度减少,平衡向正反应方向移动,正反应为吸热反应,△H>0,
故答案为:大于;升温,A的浓度减少,平衡向正反应方向移动;
(4)实验②中进行到4.0min时A减少0.1mol/L-0.078mol/L=0.022mol/L,则B减少0.044mol/L,vB=$\frac{△c}{△t}$=$\frac{0.044mol/L}{4min}$=0.011mol/(L.min),
故答案为:0.011mol/(L.min).
点评 本题考查化学平衡计算,为高频考点,把握图中浓度的变化、速率计算及平衡移动为解答的关键,侧重分析与应用能力的考查,注意图中浓度变化,题目难度不大.

| A. | 1:3 | B. | 1:5 | C. | 5:1 | D. | 3:1 |
(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.8kJ•mol-1.
(2)氨气、空气可以构成燃料电池,则原电解质溶液显碱性(填“酸性”、“中性”或“碱性”),
负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)在0.5L的密闭容器中,一定量的N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=akJ/mol,其化学平衡常数K与温度的关系如下:
| 温度/oC | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400oC时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol,此时刻该反应的v正(N2)<v逆(N2)(填“>”、“<”或“=”).
(4)25oC时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,反应的情况可能为a(填字母序号).
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$.
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |

| A. | M中达到平衡后再通入一定量的氦气,平衡不移动,容器内气体的密度不变 | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A>B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | N中达到平衡后再通入一定量的氦气时,v(正)<v(逆) |
| A. | 质子数与中子数相等的硫原子:${\;}_{16}^{32}$S | |
| B. | Al3+的结构示意图: | |
| C. | CaO2的电子式: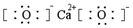 | |
| D. | 2-溴丙烷的结构简式:C3H7Br |
| A. | CuCl2[CuCl2溶液] | B. | AgNO3[Ag2O] | C. | NaCl[HCl溶液] | D. | CuSO4[CuSO4] |
 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.