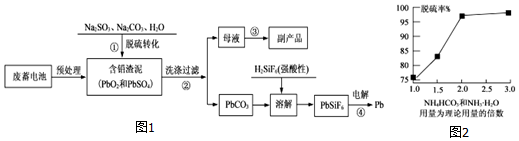
题目内容
18.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是( )| A. | CuCl2[CuCl2溶液] | B. | AgNO3[Ag2O] | C. | NaCl[HCl溶液] | D. | CuSO4[CuSO4] |
分析 用惰性电极电解电解质溶液时,一段时间后,要使电解后溶液恢复原状,应该遵循“析出什么加入什么”原则,据此分析解答.
解答 解:A.电解氯化铜溶液时,阴极上析出Cu、阳极上析出氯气,所以相当于析出CuCl2,所以要使溶液恢复原状应该加入CuCl2,但CuCl2溶液中含有CuCl2和水,所以不符合题干,故A错误;
B.电解硝酸银溶液时,阴极上析出Ag,阳极上析出O2,所以相当于析出Ag2O,所以加入Ag2O即可使溶液恢复原状,故B正确;
C.电解氯化钠溶液时,阴极上析出氢气、阳极上析出氧气,所以相当于析出HCl,通入适量HCl即可使溶液恢复原状,如果加入盐酸溶液,不仅含有HCl还含有水,不符合题意,故C错误;
D.电解硫酸铜溶液时,阳极析出氧气、阴极析出Cu,所以相当于析出CuO,要使溶液恢复原状加入适量CuO即可,故D错误;
故选B.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,根据“析出什么加入什么”原则分析解答加快,注意HCl和HCl溶液不同,易错选项是C,题目难度不大.

练习册系列答案
相关题目
9.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的( )
| A. | ②④ | B. | ③⑤ | C. | ①②④ | D. | ①③⑤ |
3.从2mol/L的NaOH溶液中取出100mL,下列关于这100mL溶液的叙述中错误的是( )
| A. | 含NaOH 0.2mol | B. | 浓度2mol/L | ||
| C. | 含NaOH 4g | D. | 溶质的质量分数与原溶液相同 |
10.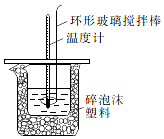 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)环形玻璃搅拌棒的作用是使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致.
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10-3kJ/(g•℃),则该反应的中和热△H=-56.8 kJ/mol.
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)环形玻璃搅拌棒的作用是使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致.
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值偏小(填“偏大”、“偏小”或“不变”).
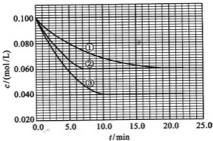 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.