题目内容
8.下列说法中,正确的是( )| A. | RCOOH与R′OH发生酯化反应时生成R′OOCR | |
| B. | 能与NaOH溶液反应,分子式为C2H4O2的有机物一定是羧酸 | |
| C. | 甲酸乙酯、乙酸甲酯、丙酸互为同分异构体 | |
| D. | 甲醛与乙酸乙酯的最简式相同 |
分析 A.酯化反应中羧酸脱-OH,醇脱H;
B.能与NaOH溶液反应,为羧酸或酯;
C.甲酸乙酯、乙酸甲酯、丙酸的分子式均为C3H6O2,结构不同;
D.甲醛为CHO,乙酸乙酯为C4H8O2.
解答 解:A.酯化反应中羧酸脱-OH,醇脱H,则RCOOH与R′OH发生酯化反应时生成R′OOCR,故A正确;
B.能与NaOH溶液反应,为羧酸或酯,则分子式为C2H4O2的有机物不一定是羧酸,故B错误;
C.甲酸乙酯、乙酸甲酯、丙酸的分子式均为C3H6O2,结构不同,互为同分异构体,故C正确;
D.甲醛为CHO,乙酸乙酯为C4H8O2,最简式不相同,故D错误;
故选AC.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质为解答的关键,侧重分析与应用能力的考查,注意羧酸、酯的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列电子式书写正确的是( )
| A. | 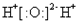 | B. | Cl:Cl | C. | 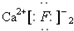 | D. |  |
6.关于铝原子或铝离子的结构错误的是( )
| A. | 原子的最外层电子数等于电子层数 | |
| B. | 反应中可失去三个电子,比镁、钠还原性弱 | |
| C. | 失去电子的铝离子半径比铝原子小 | |
| D. | 铝离子比镁离子、钠离子的半径大 |
3.下列离子方程式的写法正确的是( )
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:Fe+2H+═Fe2++H2↑ |
13.下列离子方程式中,书写不正确的是( )
| A. | 常温下,Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 稀H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-═BaSO4↓+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
17.某溶液仅含如表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol.
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入少量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变.
请推断:
(1)原溶液中含有的阳离子是Fe2+、Mg2+; 含有的阴离子是Cl-、NO3-、SO42-.
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
| 阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- NO3- SO42- |
②若向原溶液中加入少量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变.
请推断:
(1)原溶液中含有的阳离子是Fe2+、Mg2+; 含有的阴离子是Cl-、NO3-、SO42-.
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
18. 国庆期间对大量盆栽鲜花施用了S诱抗素制剂,以保证鲜花盛开.S诱抗素的分子结构如图.下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S诱抗素制剂,以保证鲜花盛开.S诱抗素的分子结构如图.下列关于该物质的说法正确的是( )
 国庆期间对大量盆栽鲜花施用了S诱抗素制剂,以保证鲜花盛开.S诱抗素的分子结构如图.下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S诱抗素制剂,以保证鲜花盛开.S诱抗素的分子结构如图.下列关于该物质的说法正确的是( )| A. | 该有机物的分子式为C15H22O4 | |
| B. | 该有机物能发生取代、加成和酯化反应 | |
| C. | 1 mol该有机物与足量溴反应最多消耗4 mol Br2 | |
| D. | 1 mol该有机物与足量Na反应生成2 mol H2 |