题目内容
 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )| A、电流计指针不发生偏转 |
| B、Al、Pt两电极有氢气生成 |
| C、Mg、C两电极生成的气体在一定条件下可以恰好完全反应 |
| D、甲池pH减小,乙池pH不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:关闭开关S甲装置形成原电池反应,铝做负极失电子发生氧化反应,镁做正极,电极上得到电子发生还原反应,乙池为电解池,Pt做电解池阴极,C做电解池的阳极,
A.电流计有电流通过;
B.铝电极是原电池负极溶解无气体生成,Pt电极上氢离子得到电子生成氢气;
C.镁电极生成的氢气,C电极生成的是氧气分析;
D.甲装置是原电池消耗氢氧根离子,溶液PH减小;乙池是电解池,电极水溶液浓度增大,氢氧化钠溶液PH增大.
A.电流计有电流通过;
B.铝电极是原电池负极溶解无气体生成,Pt电极上氢离子得到电子生成氢气;
C.镁电极生成的氢气,C电极生成的是氧气分析;
D.甲装置是原电池消耗氢氧根离子,溶液PH减小;乙池是电解池,电极水溶液浓度增大,氢氧化钠溶液PH增大.
解答:
解:关闭开关S甲装置形成原电池反应,铝做负极失电子发生氧化反应,镁做正极,电极上得到电子发生还原反应,乙池为电解池,Pt做电解池阴极,C做电解池的阳极,
A.甲装置形成的原电池,反应过程中有电子转移产生电流,电流计有电流通过,故A错误;
B.铝电极是原电池负极溶解无气体生成,Pt电极上氢离子得到电子生成氢气,故B错误;
C.镁电极生成的氢气,C电极生成的是氧气,依据电子守恒可知生成2mol氢气同时生成1mol氧气,氢气和氧气恰好反应生成水,故C正确;
D.甲装置是原电池消耗氢氧根离子,溶液PH减小;乙池是电解池,电极水溶液浓度增大,氢氧化钠溶液PH增大,故D错误.
故选C.
A.甲装置形成的原电池,反应过程中有电子转移产生电流,电流计有电流通过,故A错误;
B.铝电极是原电池负极溶解无气体生成,Pt电极上氢离子得到电子生成氢气,故B错误;
C.镁电极生成的氢气,C电极生成的是氧气,依据电子守恒可知生成2mol氢气同时生成1mol氧气,氢气和氧气恰好反应生成水,故C正确;
D.甲装置是原电池消耗氢氧根离子,溶液PH减小;乙池是电解池,电极水溶液浓度增大,氢氧化钠溶液PH增大,故D错误.
故选C.
点评:本题考查了原电池、电解池原理的应用,主要是电极名称、电极反应、电极判断方法的应用,原电池的判断是解题关键,题目难度中等.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列各组中两种物质发生变化时,所克服的作用力属于同种类型的是( )
| A、二氧化硅和氯化镁熔化 |
| B、碘和氯化铵受热变成气体 |
| C、钠和硫受热变成气体 |
| D、氯化钠和硝酸钠溶于水 |
下列说法中,正确的是:( )
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合一定形成离子键.
③离子键的实质是阳离子、阴离子间的相互吸引.
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键.
⑤某些共价化合物中含有离子键.
①在水中氢、氧原子间均以化学键相结合.
②金属和非金属化合一定形成离子键.
③离子键的实质是阳离子、阴离子间的相互吸引.
④根据电离方程式HCl=H++Cl-,判断HCl分子里存在离子键.
⑤某些共价化合物中含有离子键.
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
20°C时有ag硫酸铜溶液VmL.将溶液蒸发掉bg水后恢复到20°C,恰好全部生成硫酸铜晶体(CuSO4?5H2O),则下列关系式错误的是( )
A、原硫酸铜溶液的密度为ρ=
| ||
B、原硫酸铜溶液的物质的量浓度为c(CuSO4)=
| ||
C、原硫酸铜溶液的质量分数ω(CuSO4)=
| ||
D、生成硫酸铜晶体的物质的量为
|
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、1mol Na2SO4溶于水中,所得溶液中Na+个数为NA |
| B、18g水含有电子数为8NA |
| C、标准状况下,22.4L氢气含有氢原子个数为2NA |
| D、22.4L氢气一定含有NA 个氢分子 |
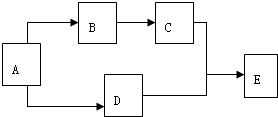 有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题:
有A、B、C、D、E五种物质,在一定条件下的相互转化关系如图所示.已知:常温下E为无色液体,C、D为无色气体单质,A为金属单质,B为淡黄色固体,请回答下列问题: