题目内容
20°C时有ag硫酸铜溶液VmL.将溶液蒸发掉bg水后恢复到20°C,恰好全部生成硫酸铜晶体(CuSO4?5H2O),则下列关系式错误的是( )
A、原硫酸铜溶液的密度为ρ=
| ||
B、原硫酸铜溶液的物质的量浓度为c(CuSO4)=
| ||
C、原硫酸铜溶液的质量分数ω(CuSO4)=
| ||
D、生成硫酸铜晶体的物质的量为
|
考点:物质的量浓度的相关计算,溶液中溶质的质量分数及相关计算
专题:计算题
分析:A.根据密度定义ρ=
计算;
B.硫酸铜晶体的质量为(a-b)g,计算硫酸铜的物质的量,根据c=
计算硫酸铜溶液的物质的量浓度;
C.根据m=nM计算硫酸铜的质量,再根据质量分数定义计算;
D.硫酸铜晶体的质量为(a-b)g,根据n=
计算生成硫酸铜晶体的物质的量.
| m |
| V |
B.硫酸铜晶体的质量为(a-b)g,计算硫酸铜的物质的量,根据c=
| n |
| V |
C.根据m=nM计算硫酸铜的质量,再根据质量分数定义计算;
D.硫酸铜晶体的质量为(a-b)g,根据n=
| m |
| M |
解答:
解:A.Vml硫酸铜溶液质量ag,所以溶液的密度为ρ=
=ag/mL,故A正确;
B.硫酸铜晶体的质量为(a-b)g,生成硫酸铜晶体的物质的量为
=
mol,所以原硫酸铜溶液的
=
mol/L,故B错误;
C.硫酸铜的物质的量为
mol,原硫酸铜溶液的质量分数ω(CuSO4)=
×100%=
%,故C错误;
D.硫酸铜晶体的质量为(a-b)g,生成硫酸铜晶体的物质的量为
=
mol,故D正确.
故选:C.
| ag |
| VmL |
B.硫酸铜晶体的质量为(a-b)g,生成硫酸铜晶体的物质的量为
| (a-b)g |
| 250g/mol |
| a-b |
| 250 |
| ||
| V×10-3L |
| 4(a-b) |
| V |
C.硫酸铜的物质的量为
| a-b |
| 250 |
| ||
| ag |
| 64(a-b) |
| a |
D.硫酸铜晶体的质量为(a-b)g,生成硫酸铜晶体的物质的量为
| (a-b)g |
| 250g/mol |
| a-b |
| 250 |
故选:C.
点评:本题考查物质的量浓度、溶质质量分数、溶液密度等计算,难度不大,注意对公式的理解运用,判断硫酸铜晶体的质量是关键,有利于学生对基础知识的理解巩固.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
己知0.1mol/LNaHCO3溶液显碱性,将此溶液加水稀释后,下列说法正确的是( )
| A、稀释后,溶液中各离子浓度均变小 | ||||
| B、原溶液中,C(Na+)=C(HCO3-)+C(H2CO3)=0.1mol/L | ||||
C、稀释后,溶液中
| ||||
| D、原溶液加入少量NaOH溶液后,其碱性减弱 |
下列关于各反应类型的关系中,说法正确的是( )
| A、置换反应一定属于氧化还原反应 |
| B、离子反应一定属于氧化还原反应 |
| C、有的复分解反应属于氧化还原反应 |
| D、所有化合反应都属于氧化还原反应 |
 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )| A、电流计指针不发生偏转 |
| B、Al、Pt两电极有氢气生成 |
| C、Mg、C两电极生成的气体在一定条件下可以恰好完全反应 |
| D、甲池pH减小,乙池pH不变 |
下列表达式错误的是( )
A、甲烷的电子式: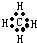 |
B、氮原子的L层电子轨道表示式: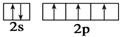 |
| C、硫离子的核外电子排布式:1s22s22p63s23p4 |
| D、碳原子最外层电子排布:2s22p2 |
下列表示对应化学反应的离子方程式正确的是( )
| A、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
 某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下: