题目内容
11.6.4g 铜与一定量硝酸充分反应后,硝酸的还原产物是NO,反应后溶液中所含 H+为 n mol,此时溶液中所含 NO3-物质的量为( )| A. | 0.28 mol | B. | 0.31 mol | C. | (n+0.2)mol | D. | (n+0.4)mol |
分析 硝酸过量,反应后溶液中溶质为Cu(NO3)2、HNO3,根据电荷守恒2n(Cu2+)+n(H+)=n(NO3-).
解答 解:n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,硝酸过量,反应后溶液中溶质为Cu(NO3)2、HNO3,反应后溶液中n(Cu2+)=0.1mol,n(H+)=nmol,
根据溶液呈电中性,可知溶液中存在:2n(Cu2+)+n(H+)=n(NO3-),则n(NO3-)=2×0.1mol+nmol=(0.2+n)mol,
故选C.
点评 本题考查化学方程式计算、氧化还原反应的计算,题目难度中等,注意从溶液电中性的角度解答,也可根据N元素守恒计算.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
1.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液,弃水层 | |
| B. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| C. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| D. | 乙醇(水):加入新制生石灰,蒸馏,收集馏出物 |
6.在下列溶液中,能大量共存的离子组是( )
| A. | 在强碱性溶液中能大量存在:Na+、K+、Cl-、HCO3- | |
| B. | 加入金属铝后溶液中有大量气泡产生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+ Na+ AlO2-、CO32- |
16.化学与材料科学息息相关,从一定意义上讲,材料是科学技术的先导,没有新材料的发展,就不可能使新的科学技术成为生产力.下列有关材料的说法不正确的是( )
| A. | 材料是为人类社会所需要并能用于制造有用器物的物质 | |
| B. | 人类使用和制造材料有悠久的历史,制造出的第一种材料是陶 | |
| C. | 体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后还可以制成其它形状的器物 | |
| D. | 高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜 |
3.下列关于石油的说法正确的是( )
| A. | 石油裂解的目的主要是为了把重油分解成相对分子量较小的烃 | |
| B. | 石油裂解可以得到氯乙烯 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化是物理变化 |
17.短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示.下列说法不正确的是( )
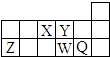

| A. | 离子半径的大小顺序为W>Q>Y>Z | |
| B. | X、Y、W三种元素的非金属性大小顺序为X>Y>W | |
| C. | X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 | |
| D. | 元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
 铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品: