题目内容
6.下列说法正确的是(NA为阿伏加德罗常数)( )| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为3NA | |
| C. | 12 g金刚石中含有C-C键的个数为2NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |
分析 A.每个白磷分子中含有6个共价键,根据白磷的分子个数计算白磷中含有的P-P共价键个数;
B.在石墨晶体中1个C原子对应3×$\frac{1}{2}$=$\frac{3}{2}$个C-C键;
C.每个C原子与其他4个C原子共用4个C-C键,相当于每个C原子占有4×$\frac{1}{2}$=2个C-C键;
D.SiO2晶体中1个Si原子对应4个Si-O键.
解答 解:A.一个白磷分子中含有6个P-P键,124gP4的物质的量是1mol,所以含有P-P键的个数为6NA,故A错误;
B.在石墨晶体中1个C原子对应3×$\frac{1}{2}$=$\frac{3}{2}$个C-C键,12 g石墨中含有C-C键的个数为1.5NA,故B错误;
C.每个C原子与其他4个C原子共用4个C-C键,相当于每个C原子占有4×$\frac{1}{2}$=2个C-C键,1mol金刚石含2molC-C键,故C正确;
D.SiO2晶体中1个Si原子对应4个Si-O键,60gSiO2中含Si-O键的个数为4NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-中的几种.分别取样进行以下实验:①用pH计测试,溶液显弱酸性;②加新制氯水和淀粉溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | S 2- | D. | NH4+ |
11.A、B、C、D、E是五种短周期元素.已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等.甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子.
请回答下列问题:
(1)C的最低价氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):H2O>CH4
(2)元素E在周期表中的位置为第三周期VIIA族
(3)请写出两种与乙具有相同电子数的非单核离子的化学式:NH4+和OH-
(4)把D的单质放到NaOH溶液中,反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(5)写出甲的电子式: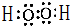
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol•L-1 NaOH 溶液的体积是:80mL.
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
(1)C的最低价氢化物与乙相比较,稳定性强弱关系(用相应的化学式表示):H2O>CH4
(2)元素E在周期表中的位置为第三周期VIIA族
(3)请写出两种与乙具有相同电子数的非单核离子的化学式:NH4+和OH-
(4)把D的单质放到NaOH溶液中,反应的化学方程式为:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(5)写出甲的电子式:
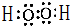
(6)有200mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.3mol•L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol•L-1 NaOH 溶液的体积是:80mL.
 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示.则构成原电池时b极为:正极,溶液中的Cu2+移向b极(填“a”或“b”);构成电解池时,如果a与电源的正极相连则a极为阳极,溶液中的Cu2+移向b极(填“a”或“b”);当电路中通过0.1mol电子时,则在阴极上生成0.05mol的铜.
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示.则构成原电池时b极为:正极,溶液中的Cu2+移向b极(填“a”或“b”);构成电解池时,如果a与电源的正极相连则a极为阳极,溶液中的Cu2+移向b极(填“a”或“b”);当电路中通过0.1mol电子时,则在阴极上生成0.05mol的铜.

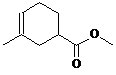 、
、
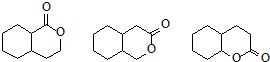 (其中任意一种).
(其中任意一种).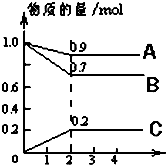 某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析: