题目内容
16. 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示.则构成原电池时b极为:正极,溶液中的Cu2+移向b极(填“a”或“b”);构成电解池时,如果a与电源的正极相连则a极为阳极,溶液中的Cu2+移向b极(填“a”或“b”);当电路中通过0.1mol电子时,则在阴极上生成0.05mol的铜.
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示.则构成原电池时b极为:正极,溶液中的Cu2+移向b极(填“a”或“b”);构成电解池时,如果a与电源的正极相连则a极为阳极,溶液中的Cu2+移向b极(填“a”或“b”);当电路中通过0.1mol电子时,则在阴极上生成0.05mol的铜.
分析 构成原电池时,较活泼的金属铁a作负极,较不活泼的金属铜b作正极,铜离子移向正极b;
构成电解池时,与正极相连的a极是阳极,铜离子移向阴极b,并在阴极得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,由此分析解答.
解答 解:构成原电池时,较活泼的金属铁a作负极,负极上金属失电子发生氧化反应,较不活泼的金属铜b作正极,正极上得电子发生还原反应,铜离子移向正极b得电子生成铜;构成电解池时,与正极相连的a极是阳极,阳极发生氧化反应,铜离子移向阴极b,并在阴极得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,当电路中通过0.1mol电子时,阴极生成铜的物质的量为0.1mol÷2=0.05mol,
故答案为:正;b;阳;b;阴;0.05.
点评 本题考查了原电池和电解池工作原理,难度不大,能准确判断原电池的正负极和电解池的阴阳极是解本题的关键,注意电解质溶液中离子的运动方向.

练习册系列答案
相关题目
6.下列操作达不到预期目的是( )
①苯和硝基苯混合物采用分液的方法分离 ②用硫酸铜溶液除去乙炔中含有的H2S
③用乙醇和5%的硫酸共热到170℃制取乙烯
④向苯酚的饱和溶液中滴加稀溴水制备三溴苯酚
⑤在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色.
①苯和硝基苯混合物采用分液的方法分离 ②用硫酸铜溶液除去乙炔中含有的H2S
③用乙醇和5%的硫酸共热到170℃制取乙烯
④向苯酚的饱和溶液中滴加稀溴水制备三溴苯酚
⑤在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色.
| A. | 只有①③⑤ | B. | 只有②③④ | C. | ①②③④⑤ | D. | 只有①③④ |
7.下列有关说法正确的是( )
| A. | 通常由相应的烃通过卤代反应制得的有: | |
| B. |  互为同分异构体 互为同分异构体 | |
| C. |  分子中所有碳原子都一定在同一平面上 分子中所有碳原子都一定在同一平面上 | |
| D. | 聚合 物可由单体CH3CH═CH2和 CH2═CH2加聚制得 物可由单体CH3CH═CH2和 CH2═CH2加聚制得 |
4.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变 | |
| B. | 对于可逆反应2CO+2NO?N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 | |
| D. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
1.丙烷的分子结构可简写成键线式结构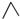 ,有机物A的键线式结构为
,有机物A的键线式结构为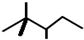 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
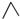 ,有机物A的键线式结构为
,有机物A的键线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A.下列有关说法错误的是( )| A. | 有机物A的一氯取代物只有4种 | |
| B. | 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷 | |
| C. | 有机物A的分子式为C8H18 | |
| D. | B的结构可能有3种 |
8.下列反应既属于氧化还原反应,又属于放热反应的是( )
| A. | 氢氧化钠溶液与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | 灼热的木炭与CO2的反应 |
5.关于乙烯基乙炔(CH≡C-CH=CH2)分子的说法错误的是( )
| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 1 mol乙烯基乙炔能与3 mol Br2发生加成反应 | |
| C. | 乙烯基乙炔分子内含有两种官能团 | |
| D. | 该物质最多有4个碳原子在同一直线上 |
6.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为3NA | |
| C. | 12 g金刚石中含有C-C键的个数为2NA | |
| D. | 60gSiO2中含Si-O键的个数为2NA |