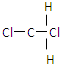题目内容
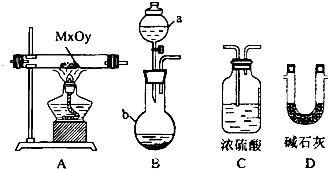
3.单晶硅是信息产业中重要的基础材料.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,AlCl3,FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(1)写出装置A中发生反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,装置D的硬质玻璃管中发生的主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(2)装置C中的试剂是浓硫酸;D、E间导管短且粗的原因是防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管.
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH、0.01mol/L KMnO4溶液、溴水、淀粉-KI、品红等溶液.
取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验:请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 则假设3成立 |
分析 制备四氯化硅的实验流程:A中发生二氧化锰与浓盐酸的反应生成氯气,MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯,最后G处理含氯气的尾气.
(1)二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水;在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳;
(2)C装置中浓硫酸干燥氯气;D中石英砂中的铁、铝等杂质也能转化为相应氯化物;
(3)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液(或溴水)褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3.
解答 解:(1)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO;
(2)C装置中浓硫酸干燥氯气,D中石英砂中的铁、铝等杂质也能转化为相应氯化物,D、E间导管短且粗防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管,
故答案为:浓硫酸;防止生成物中的AlCl3,FeCl3等杂质凝结成固体堵塞导管;
(3)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,故答案为:只有ClO-;
(3)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4(或溴水);②品红;③淀粉-KI;若溶液变为蓝色.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:已知:
①A、B、C、D、G含有同种元素.
②E 是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.B具有氧化性,液显黄色,能将SO2氧化为F(H2SO4),F与A反应生成E、G.
③
| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色(粉末状时为黑色)黄色红 | 褐色 | 红棕色 | 浅绿色 |
(1)请写出E的电子式
 .
.(2)D的化学式Fe2O3.
(3)请写出ABCDG所含的同种元素的原子结构示意图
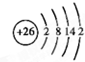 .
.(4)G生成C的过程中所出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(5)写出A→B化学方程式:2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(6)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2C≡CH 1-丁炔 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大.
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 (KMnO4)=1.5×10-2mol•L-1•min-1或0.015 mol•L-1•min-1.
(3)该小组同学根据经验绘制了 (Mn2+) 随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的实验资料发现,该实验过程中 (Mn2+) 随时间变化的趋势应如图乙所示. 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究.
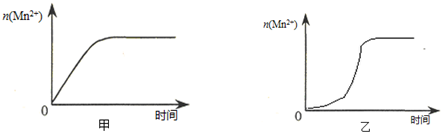
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并选择表中空白处应加入的物质.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
③若该小组同学提出的假设成立,应观察到的现象是实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min.
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下: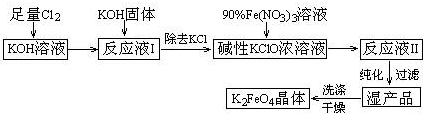
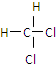 和
和