题目内容
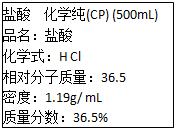 如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:
如图是学校实验室从化学试剂商店买回的盐酸试剂标签上的部分内容,据此,完成下列问题:(1)实验室从化学试剂商店买回的盐酸试剂属于
(2)上述盐酸试剂的物质的量的浓度为
(3)用上述溶液配制1mol?L-1的稀盐酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒
⑧移液管 ⑨滴定管
A.⑥③⑧⑤①②B.⑦⑤③①⑨②C.④⑤③②①⑨D.⑥⑤①③②
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会
②容量瓶中原来有少量蒸馏水,浓度会
③使用容量瓶配制溶液时,俯视液面定容,浓度会
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面
考点:配制一定物质的量浓度的溶液,物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)盐酸是HCl的水溶液,据此分析;
(2)根据C=
来计算;
(3)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器和使用步骤;
(4)根据c=
和通过分析溶质的物质的量或溶液的体积的变化来分析C的变化;
(5)实验过程中出现的情况,如果能弥补则想办法弥补,如果不能弥补则须重新配制.
(2)根据C=
| 1000ρω% |
| M |
(3)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器和使用步骤;
(4)根据c=
| n |
| V |
(5)实验过程中出现的情况,如果能弥补则想办法弥补,如果不能弥补则须重新配制.
解答:
解:(1)盐酸是HCl的水溶液,为混合物,故答案为:混合物;
(2)根据C=
可知盐酸溶液的浓度C=
=11.9mol/L,故答案为:11.9mol/L;
(3)用11.9mol/L的浓盐酸配制1mol?L-1的稀盐酸100mL,所需要的浓盐酸的体积V=
=8.4ml.配制步骤和使用的仪器为:①量取:需要的浓盐酸是8.4ml,故选用10ml的量筒;②稀释:用到50ml的烧杯和玻璃棒;③移液:由于配制100ml稀盐酸,故选用100ml容量瓶;④洗涤:用到烧杯和玻璃棒;⑤定容:用到胶头滴管;⑥摇匀;⑦装瓶;故用到仪器的先后顺序为:⑥⑤①③②或⑥①⑤③②,故选D.
(4)①转移完溶液后未洗涤玻璃棒和烧杯,会造成溶质损失,则浓度会偏小,故答案为:偏小;
②容量瓶中原来有少量蒸馏水,只要在定容时让凹液面与刻度线相切即可,至于水是原来有的还是后来加入的,对浓度无影响,故答案为:无影响;
③使用容量瓶配制溶液时,俯视液面定容会造成溶液体积偏小,浓度会偏大,故答案为:偏大;
(5)①加蒸馏水时不慎超过了刻度线这种操作失误无法弥补,故需重新配制,故答案为:重新配制;
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面,由于不知损失的溶质为多少,故这种操作失误无法弥补,需重新配制,故答案为:重新配制.
(2)根据C=
| 1000ρω% |
| M |
| 1000×1.19g/ml×36.5% |
| 36.5 |
(3)用11.9mol/L的浓盐酸配制1mol?L-1的稀盐酸100mL,所需要的浓盐酸的体积V=
| 1mol/L×0.1L |
| 11.9mol/L |
(4)①转移完溶液后未洗涤玻璃棒和烧杯,会造成溶质损失,则浓度会偏小,故答案为:偏小;
②容量瓶中原来有少量蒸馏水,只要在定容时让凹液面与刻度线相切即可,至于水是原来有的还是后来加入的,对浓度无影响,故答案为:无影响;
③使用容量瓶配制溶液时,俯视液面定容会造成溶液体积偏小,浓度会偏大,故答案为:偏大;
(5)①加蒸馏水时不慎超过了刻度线这种操作失误无法弥补,故需重新配制,故答案为:重新配制;
②向容量瓶中转移溶液时,不慎有液滴掉在容量瓶外面,由于不知损失的溶质为多少,故这种操作失误无法弥补,需重新配制,故答案为:重新配制.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
从宏观上来说物质由元素组成,从微观上物质由粒子构成,下列说法不正确的是( )
| A、54Fe和56Fe互为同位素 |
| B、质子数等于电子数的某微粒,可能是一种分子或离子 |
| C、只有一种分子组成的一定为纯净物 |
| D、16gO2和16gO3含有的原子数相等 |
除去NaCl溶液中MgC12、CaC12的方法是( )
| A、将样品溶于蒸馏水,加入过量NaOH过滤后,加盐酸蒸发 |
| B、将样品溶于蒸馏水,加入过量 Na2CO3过滤后,加盐酸蒸发 |
| C、将样品溶于蒸馏水,加入过量Ca(OH)2过滤,然后加过量Na2CO3过滤,在滤液中加过量盐酸后蒸发 |
| D、用半透膜有选择地除去Ca2+、Mg2+ |