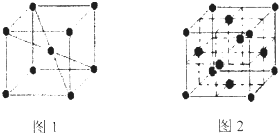
题目内容
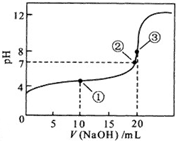 常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.
常温下,用0.10mol?L-1NaOH溶液滴定 20.00mL 0.10mol?L-1 CH3COOH溶液滴定曲线如图.按要求完成下列各题
(1)若CH3COOH溶液装在锥形瓶中,应选用
(2)若滴定前读数准确,滴定终点时仰视刻度线,则测得的结果
(3)点①所示溶液中离子电荷守恒的关系式为
(4)点②所示溶液中离子浓度大小关系为
(5)点③所示溶液中c(CH3COOH)+c(CH3COO-)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)滴定终点时,溶质为CH3COONa溶液由酸性变为碱性;
(2)滴定终点时仰视滴定管液面,读数偏高;
(3)在滴定过程中,溶液中离子电荷始终守恒;
(4)pH=7时,溶液呈中性.根据电荷守恒就可得知c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(5)恰好完全反应时,溶质为CH3COONa,根据物料守恒可得c(CH3COOH)+c(CH3COO-)=0.05mol?L-1.
(2)滴定终点时仰视滴定管液面,读数偏高;
(3)在滴定过程中,溶液中离子电荷始终守恒;
(4)pH=7时,溶液呈中性.根据电荷守恒就可得知c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(5)恰好完全反应时,溶质为CH3COONa,根据物料守恒可得c(CH3COOH)+c(CH3COO-)=0.05mol?L-1.
解答:
解:(1)滴定终点时,溶质为CH3COONa溶液,醋酸钠溶液中醋酸根离子水解显碱性,溶液由酸性变为碱性,若CH3COOH溶液装在锥形瓶中,应选用酚酞试液作指示剂,达到滴定终点时的标志为溶液由无色变为浅红色且半分钟内不腿色,
故答案为:酚酞试液;溶液由无色变为浅红色且半分钟内不腿色;
(2)滴定终点时仰视滴定管液面,读取的标准溶液体积增大,读数偏高,则测得的结果偏高,大于0.10mol?L-1;
故答案为:>;
(3)在滴定过程中,溶液中离子电荷始终守恒,点①所示溶液中为醋酸和醋酸钠的混合溶液,溶液中离子电荷守恒的关系式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故答案为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+);
(4)pH=7时,溶液呈中性,c(H+)=c(OH-),根据电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)=c(CH3COO-),就可得知c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(5)点③所示溶液中恰好完全反应时,溶质为CH3COONa,根据物料守恒可得c(CH3COOH)+c(CH3COO-)=0.05mol?L-1,故答案为:0.05.
故答案为:酚酞试液;溶液由无色变为浅红色且半分钟内不腿色;
(2)滴定终点时仰视滴定管液面,读取的标准溶液体积增大,读数偏高,则测得的结果偏高,大于0.10mol?L-1;
故答案为:>;
(3)在滴定过程中,溶液中离子电荷始终守恒,点①所示溶液中为醋酸和醋酸钠的混合溶液,溶液中离子电荷守恒的关系式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故答案为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+);
(4)pH=7时,溶液呈中性,c(H+)=c(OH-),根据电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)=c(CH3COO-),就可得知c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(5)点③所示溶液中恰好完全反应时,溶质为CH3COONa,根据物料守恒可得c(CH3COOH)+c(CH3COO-)=0.05mol?L-1,故答案为:0.05.
点评:本题考查NaOH与CH3COOH的反应,涉及盐类的水解和溶液离子浓度的大小比较,注意利用电荷守恒的角度做题,选项D为易错点,加NaOH与酸反应则c(Na+)>c(OH-),题目难度中等.

练习册系列答案
相关题目