题目内容
硫酸是化学工业中的重要原料,我国已成为全球硫酸产能最高、产量最大的国家.
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气.当浓硫酸浓度降到16mol/L(密度1.8g/cm3)以下时,则失去干燥能力.
①16mol/L的硫酸的质量分数为 (保留两位小数,下同).
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水 g.
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 19.840g,与足量稀硫酸反应,收集到气体5.376L(换算到标准状况),质量为6.880g.则固体M的成分为 (写化学式),其中铁元素与硫元素的质量比为 .
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20).
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为 .
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为 %.
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐.为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.
部分测定结果如下:
铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同;
铵盐质量为30.000g时,浓硫酸质量增重0.680g;
铵盐质量为40.000g时,浓硫酸的质量不变.
①计算该混合盐中氮元素的质量分数.
②计算上述氢氧化钠溶液的物质的量浓度.
(1)18.4mol/L(质量分数0.98,密度1.84g/cm3)浓硫酸是常用的干燥剂,用于吸收潮湿气体中的水蒸气.当浓硫酸浓度降到16mol/L(密度1.8g/cm3)以下时,则失去干燥能力.
①16mol/L的硫酸的质量分数为
②50mL质量分数为0.98的浓硫酸作为干燥剂时,最多可吸水
(2)将铁粉与硫粉在隔绝空气条件下反应所得的固体M 19.840g,与足量稀硫酸反应,收集到气体5.376L(换算到标准状况),质量为6.880g.则固体M的成分为
(3)当代硫酸工业大多用接触法制硫酸(设空气中氧气的体积分数为0.20).
①为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为
②将①中的炉气经净化除尘后直接送入接触室,流量为1.00m3/s,从接触室导出气体的流量为0.95m3/s(同温同压下测定),则SO2的转化率为
(4)接触法制硫酸排放的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2(循环利用)和混合铵盐.为测定此铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.
部分测定结果如下:
铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同;
铵盐质量为30.000g时,浓硫酸质量增重0.680g;
铵盐质量为40.000g时,浓硫酸的质量不变.
①计算该混合盐中氮元素的质量分数.
②计算上述氢氧化钠溶液的物质的量浓度.
考点:化学方程式的有关计算,物质的量浓度的相关计算
专题:计算题
分析:(1)①根据c=
计算16mol/L的硫酸的质量分数;
②令吸收水的质量为mg,根据稀释前后溶质硫酸的质量不变列方程计算;
(2)收集到气体5.376L(换算到标准状况),质量为6.880g,则气体的摩尔质量=
=28.67,故气体为H2S与H2的混合气体,则固体M的成分为FeS、Fe,令FeS、Fe的物质的量分别为xmol、ymol,则生成H2S为xmol、生成H2为ymol,根据固体M的质量及气体质量列方程,再根据m=nM计算质量Fe、S元素质量之比;
(3)①发生反应:4FeS2+11O2
2Fe2O3+8SO2,设生成8molSO2,则参加反应的氧气11mol,进而计算实际通入的O2物质的量,再计算空气中氮气的物质的量、剩余氧气物质的量,进而计算二氧化硫的体积分数;
②接触室中发生反应:O2+2SO2
2SO3,设进入接触室的气体体积为1L,由流量关系可知,从接触室导出气体为0.95L,根据气体体积差量,利用差量法计算参加反应二氧化硫的体积,进而计算二氧化硫的转化率;
(4)混合铵盐为NH4HSO4、(NH4)2SO4,氢氧根先与氢离子反应,再与铵根离子反应,若铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同,说明加入10g铵盐时,氢氧化钠过量,20g时氢氧化钠不足;若铵盐质量为30.000g时,浓硫酸质量增重0.680g,说明只有部分铵根离子参加反应;若铵盐质量为40.000g时,浓硫酸的质量不变,说明氢氧化钠不足,没有与铵根离子反应生成氨气;
设50.00mLNaOH溶液含有NaOH为amol,10.000 g混合盐完全反应,假设NH4HSO4为xmol,(NH4)2SO4为ymol,根据二者质量列方程;
10.00 g时铵盐不足,由N守恒知生成n(NH3)=x+2y,20.00 g时铵盐已经过量,NH4HSO4为2xmol,(NH4)2SO4为2ymol,先发生H++OH-=H2O,再发生NH4++OH-
NH3+H2O,表示出生成氨气的物质的量,再根据10.00 g和20.00 g铵盐产生的氨气一样多列方程;
30.00 g时铵盐过量,NH4HSO4为3xmol,(NH4)2SO4为3ymol,生成n(NH3)=
=0.04mol,先发生H++OH-=H2O,再发生NH4++OH-
NH3+H2O,表示出生成氨气的物质的量,结合氢气物质的量列方程;
联立方程计算a、x、y的值,进而计算N元素质量分数、氢氧化钠溶液的物质的量浓度.
| 1000ρω |
| M |
②令吸收水的质量为mg,根据稀释前后溶质硫酸的质量不变列方程计算;
(2)收集到气体5.376L(换算到标准状况),质量为6.880g,则气体的摩尔质量=
| 6.88g | ||
|
(3)①发生反应:4FeS2+11O2
| ||
②接触室中发生反应:O2+2SO2
| ||
| △ |
(4)混合铵盐为NH4HSO4、(NH4)2SO4,氢氧根先与氢离子反应,再与铵根离子反应,若铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同,说明加入10g铵盐时,氢氧化钠过量,20g时氢氧化钠不足;若铵盐质量为30.000g时,浓硫酸质量增重0.680g,说明只有部分铵根离子参加反应;若铵盐质量为40.000g时,浓硫酸的质量不变,说明氢氧化钠不足,没有与铵根离子反应生成氨气;
设50.00mLNaOH溶液含有NaOH为amol,10.000 g混合盐完全反应,假设NH4HSO4为xmol,(NH4)2SO4为ymol,根据二者质量列方程;
10.00 g时铵盐不足,由N守恒知生成n(NH3)=x+2y,20.00 g时铵盐已经过量,NH4HSO4为2xmol,(NH4)2SO4为2ymol,先发生H++OH-=H2O,再发生NH4++OH-
| ||
30.00 g时铵盐过量,NH4HSO4为3xmol,(NH4)2SO4为3ymol,生成n(NH3)=
| 0.68g |
| 17g/mol |
| ||
联立方程计算a、x、y的值,进而计算N元素质量分数、氢氧化钠溶液的物质的量浓度.
解答:
解:(1)①根据c=
可知,密度1.8g/cm3、浓度为16mol/L的硫酸的质量分数=
=0.87,故答案为:0.87;
②令吸收水的质量为mg,根据稀释前后溶质硫酸的质量不变,则:
50mL×1.84g/mL×0.98=(50mL×1.84g/mL+mg)×
,
解得m=11.5,
故答案为:11.5;
(2)收集到气体5.376L(换算到标准状况),质量为6.880g,则气体的摩尔质量=
=28.67,故气体为H2S与H2的混合气体,则固体M的成分为FeS、Fe,令FeS、Fe的物质的量分别为xmol、ymol,则生成H2S为xmol、生成H2为ymol,故
,解得x=0.2 y=0.04,所以铁元素与硫元素的质量之比为:(0.2+0.04)×56:0.2×32=21:10,
故答案为:FeS、Fe;21:10;
(3)①发生反应:4FeS2+11O2
2Fe2O3+8SO2,设生成8molSO2,则参加反应的氧气11mol,实际通入的O2为(1+40%)×11mol=15.4mol,所以空气中氮气为4×15.4mol=61.6mol,剩余氧气为15.4mol-11mol=4.4mol,则煅烧后炉气中SO2的体积分数为
=0.11,
故答案为:0.11;
②接触室中发生反应:O2+2SO2
2SO3,设进入接触室的气体体积为1L,由流量关系可知,从接触室导出气体为0.95L,气体体积减小量=1L-0.95L=0.05L,由方程式可知有2体积二氧化硫反应,气体总体积减小1体积,故参加反应的二氧化硫为0.05L×2=0.1L,进入接触室的气体中体SO2的积为1L×
=
L,故二氧化硫的转化率=
×100%=92.5%,
故答案为:92.5;
(4)混合铵盐为NH4HSO4、(NH4)2SO4,氢氧根先与氢离子反应,再与铵根离子反应,若铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同,说明加入10g铵盐时,氢氧化钠过量,20g时氢氧化钠不足;若铵盐质量为30.000g时,浓硫酸质量增重0.680g,说明只有部分铵根离子参加反应;若铵盐质量为40.000g时,浓硫酸的质量不变,说明氢氧化钠不足,没有与铵根离子反应生成氨气,
设50.00mLNaOH溶液含有NaOH为amol,10.000 g混合盐完全反应,假设其中NH4HSO4为xmol,(NH4)2SO4为ymol,由二者质量之和可得:115x+132y=10;
10.00 g时铵盐不足,由N守恒知n(NH3)=x+2y,20.00 g时铵盐已经过量,NH4HSO4为2xmol,(NH4)2SO4为2ymol,则:
H++OH-=H2O
2x 2x
NH4++OH-
NH3+H2O,
(a-2x)(a-2x)
由于10.00 g和20.00 g铵盐产生的氨气一样多,n(NH3)=x+2y=a-2x;
30.00 g时铵盐过量,NH4HSO4为3xmol,(NH4)2SO4为3ymol,则n(NH3)=
=0.04mol,则:
H++OH-=H2O
3x 3x
NH4+OH-
NH3+H2O,
(a-3x)(a-3x)
所以a-3x=0.04;
联立方程,解得a=0.232,x=0.064,y=0.02
①该混合盐中氮元素的质量分数=
×100%=14.56%,
②上述氢氧化钠溶液的物质的量浓度=
=4.64mol/L,
答:①该混合盐中氮元素的质量分数为14.56%.
②上述氢氧化钠溶液的物质的量浓度为4.64mol/L.
| 1000ρω |
| M |
| 16×98 |
| 1000×1.8 |
②令吸收水的质量为mg,根据稀释前后溶质硫酸的质量不变,则:
50mL×1.84g/mL×0.98=(50mL×1.84g/mL+mg)×
| 16×98 |
| 1000×1.8 |
解得m=11.5,
故答案为:11.5;
(2)收集到气体5.376L(换算到标准状况),质量为6.880g,则气体的摩尔质量=
| 6.88g | ||
|
|
故答案为:FeS、Fe;21:10;
(3)①发生反应:4FeS2+11O2
| ||
| 8mol |
| 8mol+4.4mol+61.6mol |
故答案为:0.11;
②接触室中发生反应:O2+2SO2
| ||
| △ |
| 8mol |
| 8mol+4.4mol+61.6mol |
| 4 |
| 37 |
| 0.1L | ||
|
故答案为:92.5;
(4)混合铵盐为NH4HSO4、(NH4)2SO4,氢氧根先与氢离子反应,再与铵根离子反应,若铵盐质量为10.000g和20.000g时,浓硫酸增加的质量相同,说明加入10g铵盐时,氢氧化钠过量,20g时氢氧化钠不足;若铵盐质量为30.000g时,浓硫酸质量增重0.680g,说明只有部分铵根离子参加反应;若铵盐质量为40.000g时,浓硫酸的质量不变,说明氢氧化钠不足,没有与铵根离子反应生成氨气,
设50.00mLNaOH溶液含有NaOH为amol,10.000 g混合盐完全反应,假设其中NH4HSO4为xmol,(NH4)2SO4为ymol,由二者质量之和可得:115x+132y=10;
10.00 g时铵盐不足,由N守恒知n(NH3)=x+2y,20.00 g时铵盐已经过量,NH4HSO4为2xmol,(NH4)2SO4为2ymol,则:
H++OH-=H2O
2x 2x
NH4++OH-
| ||
(a-2x)(a-2x)
由于10.00 g和20.00 g铵盐产生的氨气一样多,n(NH3)=x+2y=a-2x;
30.00 g时铵盐过量,NH4HSO4为3xmol,(NH4)2SO4为3ymol,则n(NH3)=
| 0.68g |
| 17g/mol |
H++OH-=H2O
3x 3x
NH4+OH-
| ||
(a-3x)(a-3x)
所以a-3x=0.04;
联立方程,解得a=0.232,x=0.064,y=0.02
①该混合盐中氮元素的质量分数=
| (0.064+2×0.02)×14 |
| 10 |
②上述氢氧化钠溶液的物质的量浓度=
| 0.232mol |
| 0.05L |
答:①该混合盐中氮元素的质量分数为14.56%.
②上述氢氧化钠溶液的物质的量浓度为4.64mol/L.
点评:本题综合性较大,涉及溶液浓度计算、化学方程式计算、混合物计算,题目计算量大,过程复杂,综合考查学生分析解决问题的能力,难度较大.

练习册系列答案
相关题目
 将CH4和Cl2按体积比1:2混合充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处,如图所示下列描述正确的是( )
将CH4和Cl2按体积比1:2混合充入大试管中,将此试管倒立在盛Na2SiO3溶液的水槽里,放在光亮处,如图所示下列描述正确的是( )| A、由于Cl2不足,生物中不含有CHCl3、CCl4 |
| B、CH4和Cl2取代的产物全部都是极性分子 |
| C、水槽底部出现白色沉淀 |
| D、最终试管内全部充满溶液 |
下列反应可以组成原电池的是( )
| A、HCl+NaOH |
| B、FeCl3+NaOH |
| C、Fe+CuSO4 |
| D、NaCl+AgNO3 |
除去CuSO4溶液中含有的Fe2(SO4)3杂质,最佳的方法是加入( )
| A、CuO |
| B、H2O2 |
| C、NH3?H2O |
| D、NaOH |
在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中.发生反应;2NO2(g)?N2O4(g)△H<0.反应过程中浓度变化如下:下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol?L-1 | 平衡浓度/(mol?L-1 |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡后,分别压缩容器Ⅰ、Ⅱ,则Ⅰ、Ⅱ中气体颜色都将变深 |
| B、平衡时,Ⅰ、Ⅱ中反应物的转化率a(N2O4)<a(NO2) |
| C、平衡时,Ⅰ、Ⅱ中反应的平衡常数K(Ⅰ)═2K(Ⅱ) |
| D、平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) |
 洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题
洋蓟在国际市场上属高档蔬菜,以良好的保健功能和药用价值被冠以“蔬之皇”的美称,从洋蓟提取的洋蓟素结构如图,请回答下列问题 +A
+A
 元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
元素周期表揭示了化学元素间的内在联系,使其构成了一个完整的体系.
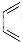 +
+ →G(抗病毒药阿昔洛韦中间体),G的结构简式为:
→G(抗病毒药阿昔洛韦中间体),G的结构简式为: