题目内容
8.将Na2O2粉末投入下列物质的饱和溶液中,恢复到室温,最终不一定产生沉淀的是( )| A. | FeCl2 | B. | AlCl3 | C. | MgCl2 | D. | NaCl |
分析 过氧化钠加入水溶液中反应生成氢氧化钠和氧气,氢氧化钠和氯化亚铁、氯化镁反应生成沉淀,和氯化铝反应生成的氢氧化铝沉淀会溶解在氢氧化钠溶液中,饱和氯化钠溶液会析出氯化钠晶体.
解答 解:过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑,
A.生成的氢氧化钠溶液和FeCl2溶液反应生成氢氧化亚铁沉淀,一定有沉淀生成,故A错误;
B.氢氧化钠和氯化铝溶液反应AlCl3+3NaOH=Al(OH)3↓+3HCl,生成的氢氧化铝和氢氧化钠会发生反应生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,可能无沉淀生成,故B正确;
C.氢氧化钠和MgCl2 溶液反应生成氢氧化镁沉淀,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,一定会生成沉淀,故C错误;
D.饱和氯化钠溶液中加入过氧化钠,反应消耗水,溶液中会析出氯化钠晶体,一定有沉淀生成,故D错误;
故选B.
点评 本题考查了物质性质,主要是过氧化钠和盐反应后沉淀生成的分析,注意氢氧化铝沉淀溶于氢氧化钠溶于,饱和溶液消耗水会析出晶体,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
19.下列说法正确的是( )
| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 中国民间说的“硝石”是指KNO3,“硝强水”HNO3水溶液 | |
| C. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| D. | 分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体异构)有5种 |
16.下列有关同分异构体数目的叙述不正确的是( )
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 与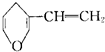 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种 | |
| D. | 菲的结构简式为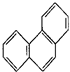 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
17.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示,关于该电池的叙述正确的是( )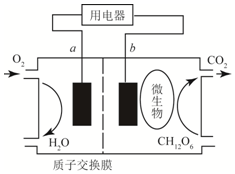

| A. | 该电池能够将电能转化为化学能 | |
| B. | b为该电池的正极 | |
| C. | 放电过程中,H+从a极区向b极区迁移 | |
| D. | 在电池反应中,正极上每消耗5.6L(标准状况下)气体时,则有NA个H通过质子交换膜 |