题目内容
19.下列说法正确的是( )| A. | 石油的分馏、裂化和煤的干馏都是化学变化 | |
| B. | 中国民间说的“硝石”是指KNO3,“硝强水”HNO3水溶液 | |
| C. | 乙烯、聚氯乙烯、苯乙烯分子结构中都含有不饱和键 | |
| D. | 分子式为C8H8O2分子结构中含有苯环且能够发生水解反应的同分异构体(不考虑立体异构)有5种 |
分析 A.有新物质生成的为化学变化,没有新物质生成的为物理变化;
B.“硝石”是指KNO3,“硝强水”是HNO3水溶液;
C.聚氯乙烯不含碳碳双键;
D.根据有机物能够发生水解反应,则应含有-COO-官能团,则取代基分别为-CH3和-OOCH或-OOCCH3或-CH2OOCH或-COOCH3、有2个取代基时,有邻、间、对三不同结构.
解答 解:A.石油的分馏没有新物质生成为物理变化,裂化和煤的干馏都有新物质生成,属于化学变化,故A错误;
B..“硝石”是指KNO3,“硝强水”是HNO3水溶液,故B正确;
C.乙烯、苯乙烯分子结构中都含有不饱和键,聚氯乙烯为氯乙烯的加聚产物,不含不饱和键,故C错误;
D.由题目要求可知该有机物的同分异构体中应具有CH3-C6H4-OOCH(-C6H4-为苯环)的结构,应有邻、间、对三种同分异构体或C6H5-OOCCH3或C6H5-CH2OOCH或C6H5-COOCH3,共6种,故D错误;
故选:B.
点评 本题为综合题,考查了物理变化与化学变化判断、有机物结构,明确相关物质的组成,基本概念,同分异构体书写是解题关键,题目难度中等.

练习册系列答案
相关题目
9. 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
(1)如图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
①写出该反应的平衡常数表达式.K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
②试判断K1>K2(填写“>”“=”或“<”).
③下列各项能说明该反应已达到平衡状态的是c(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
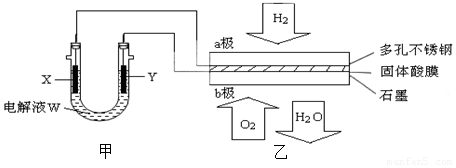
(3)化合物N2 H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2 H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图所示.

①该燃料电池的负极反应式为N2H4+4OH--4e-=4H2O+N2↑;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L.
③在t2时所得溶液的pH为1.(假设溶液体积不变)
 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.(1)如图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图.则反应过程中放出的总热量应为234kJ.
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g);△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②试判断K1>K2(填写“>”“=”或“<”).
③下列各项能说明该反应已达到平衡状态的是c(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)=3v(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)化合物N2 H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2 H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图所示.

①该燃料电池的负极反应式为N2H4+4OH--4e-=4H2O+N2↑;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1-t2时间段铁电极上的电极反应式Cu2++2e-=Cu;原混合溶液中NaCl的物质的量浓度为0.1mol/L.
③在t2时所得溶液的pH为1.(假设溶液体积不变)
11. 短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )
 短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,m是由其中两种元素组成的二元化合物,q、s是由这些元素组成的三元化合物,n是元素W的单质,且其氧化物具有两性.常温下0.1mol•L-1 q溶液的pH为13.上述物质间的转化关系如图所示,下列说法正确的是( )| A. | Y、Z元素形成的化合物中可能含有共价键 | |
| B. | 原子半径;Y<Z<W | |
| C. | 常温下s溶液的pH<7 | |
| D. | s与过量盐酸反应只生成一种正盐 |
8.将Na2O2粉末投入下列物质的饱和溶液中,恢复到室温,最终不一定产生沉淀的是( )
| A. | FeCl2 | B. | AlCl3 | C. | MgCl2 | D. | NaCl |
9.下列反应的离子方程式书写正确的是( )
| A. | SiO2与NaOH溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Fe2O3溶于盐酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 铁与足量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
 前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题:
前4周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华,常用作制冷剂;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得一个电子后3p轨道全充满;D的最高化合价和最低化合价代数和为4,其最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,广泛用于电气工业.回答下列问题: