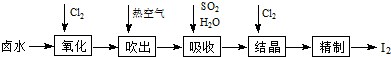
题目内容
14.通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”的时候一般更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( )①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②26Fe2+容易失电子转变为26Fe3+,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳(C)原子电子排布式为1s22s12p3而不是1s22s22p2.
| A. | ①② | B. | ②③ | C. | ③④ | D. | 全部 |
分析 根据“原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半满”、“全满”的时候一般更加稳定”,结合好玩的排布式来分析解答.
解答 解:①H、He原子核外只有s能级,H原子核外只有一个电子,未达到稳定结构,He原子核外有2个电子,已经达到稳定结构,不符合洪特规则特例,故①正确;
②26Fe2+容易失电子转变成26Fe3+,由3d6转化为3d5半满稳定状态,符合洪特规则的特例,故②正确;
③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2,[Ar]3d104s1中d轨道处于全满,s轨道处于半满,符合洪特规则的特例,故③正确;
④激发态的原子是基态原子吸收能量后发生电子跃迁形成的,不符合洪特规则特例,故④错误;
故选B.
点评 本题考查原子核外电子的排布规律,注意对洪特规则特例的理解并能用语洪特规则特例解释物质的性质与一些实验实验.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
4.在下列各组物质中,属于同系物的一组是( )
| A. | 1,1-二溴乙烷和1,2-二溴乙烷 | B. | 苯和甲苯 | ||
| C. | 乙二醇和丙三醇 | D. | 乙烯和环丙烷 |
5.下列实验合理的是( )

| A. | 得到红褐色沉淀 | B. | 吸收氨气,并防止倒吸 | ||
| C. | 制备并收集少量NO2气体 | D. | 实验室制O2 |
2.六种短周期元素(a、b、c、d、e、f)的原子序数依次增大.其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料.由此可推知( )
| A. | a、c两种元素只能组成化学式为ca3的化合物 | |
| B. | b、c、d分别与a形成的简单化合物,沸点由高到低依次为:d>c>b | |
| C. | 原子半径由大到小的顺序是 e>f>c>b>a | |
| D. | 元素的非金属性由强到弱的顺序是 d>c>f>b |
9. 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差26 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
19.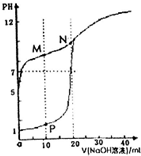 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )| A. | NaX溶液呈碱性 | B. | P点:c(Na+)>c(H+) | ||
| C. | M点:c(HX)+c(X-)=2c(Na+) | D. | M点水电离程度小于N点 |
6.14C常用于测定生物遗骸的年份.下列说法中正确的是( )
| A. | 14C的质量数为14g•mol-1 | B. | 14C与12C是两种不同的元素 | ||
| C. | 14C与C60互为同素异形体 | D. | 14C与14N中子数一定不同 |
3.W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、4、8、8,它们的最外层电子数之和为18.下列说法错误的是( )
| A. | 阴离子的还原性:W>Z | B. | 单质的沸点:W>Y | ||
| C. | 最高价氧化物的水化物的酸性:Y<Z | D. | 四种元素一定都是非金属元素 |