题目内容
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A、亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
B、标况下三氧化硫固体;
C、在燃料电池正极放电的是氧气;
D、铁在浓硫酸中会钝化.
解答 解:A、1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故A错误;
B、标况下三氧化硫固体,故不能根据气体摩尔体积来计算其物质的量,故B错误;
C、在燃料电池正极放电的是氧气,标况下22.4L氧气的物质的量为1mol,而氧气放电后变为-2价,故1mol氧气转移4mol电子即4NA个,故C正确;
D、铁在浓硫酸中会钝化,故不能反应完全,则生成的二氧化硫分子个数小于NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
2.青蒿酸(结构如图)具有致癌抗疟作用,下列有关它的叙述不正确的是( )
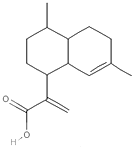

| A. | 能发生酯化反应 | B. | 属于芳香族化合物 | ||
| C. | 能与NaHCO3溶液反应 | D. | 能使溴的四氯化碳溶液褪色 |
6.1L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是( )
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 电解后溶液pH=0 | B. | a=3 | ||
| C. | 阳极生成1.5mol Cl2 | D. | 阴极析出的金属是铜与铝 |
16.室温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入pH=2的NaHSO4溶液,当溶液的pH恰好为7时,则参加反应的Ba(OH)2溶液与NaHSO4溶液的体积比是( )
| A. | 1:9 | B. | 1:1 | C. | 1:2 | D. | 1:4 |
20.实验室里需要450mL 0.1mol/L的氢氧化钠溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取1.8g氢氧化钠固体,加入450mL水 | |
| B. | 称取1.8g氢氧化钠固体配成450mL溶液 | |
| C. | 称取2.0g氢氧化钠固体,加入500mL水 | |
| D. | 称取2.0g氢氧化钠固体配成500mL溶液 |
 .
.