题目内容
7.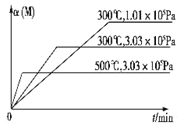 在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )| A. | x=2 | |
| B. | 平衡时,v 正 (B):v 逆 (C)=2:3 | |
| C. | 若保持容器容积不变,充入N,则C的物质的量减小 | |
| D. | 若保持容器容积不变,充入Q,反应①的平衡常数不变 |
分析 Ⅰ、在某容器中进行反应②时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,结合反应特征和M的转化率变化分析判断
反应速率之比等于化学方程式计量数之比为正反应速率之比;
Ⅱ、因为W容器中反应①是吸热反应,绝热容器中,反应①正向进行,温度降低反应②正向进行,所以反应②是放热反应;若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大,由此分析解答.
解答 解:Ⅰ、在某容器中进行反应②时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,结合反应特征和M的转化率变化分析判断
反应速率之比等于化学方程式计量数之比为正反应速率之比;
Ⅱ、因为W容器中反应①是吸热反应,绝热容器中,反应①正向进行,温度降低反应②正向进行,所以反应②是放热反应;若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大,
A、温度相同,压强改变平衡移动,说明两边的计量数不等,所以x≠2,故A错误;
B、在某容器中进行反应Ⅱ时,测得M的转化率与温度,压强关系如图所示,依据”定一议二“和“先拐先平”温度、压强高,图象变化可知温度相同,压强越大,M转化率越小,说明平衡逆向进行,逆向是气体体积减小的反应,x+1<3,x<2,化学方程式计量数为整数1,容器W内温度保持不变时反应达到平衡状态,C的正反应速率等于逆反应速率,反应速率之比等于化学方程式计量数之比为正反应速率之比,得到v正(B):v逆(C)═2:3,故B正确;
C、若向容器W中再充入N,反应②正向进行,放热反应放出热量,促进反应①正向进行,A转化率增大,C的物质的量增大,故C错误;
D、充入Q,反应②逆向移动,而正反应是放热反应,所以体系温度降低,反应①是吸热反应,所以反应①的平衡常数减小,故D错误;
故选B.
点评 本题考查了化学平衡图象分析判断方法,注意化学平衡移动原理的理解应用,注意W为绝热容器,掌握基础是关键,题目难度中等.

 口算题天天练系列答案
口算题天天练系列答案| A. | 硫酸 纯碱 孔雀石 | B. | 硝酸 烧碱 明矾 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | FeCl2溶液中加入氯水:Cl2+Fe2+═Fe3++2Cl- | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NaOH溶液与小苏打溶液反应 HCO3-+OH-═CO32-+H2O |
| A. | H2SO4→H2++SO42- | B. | NH3•H2O?NH4++OH- | ||
| C. | Ca(OH)2?Ca2++2OH- | D. | NaHCO3→Na++H++CO32- |
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2O2加到Ca(HCO3)2溶液中 ④浓硫酸铵溶液加入到浓氢氧化钡中.
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
| A. | 维生素C和脱氢维生素C | B. | 维生素C和HI | ||
| C. | I2和HI | D. | I2和脱氢维生素C |
| A. | 用聚氯乙烯树脂生产食品包装袋 | |
| B. | 用工业酒精勾兑白酒 | |
| C. | 合理利用可燃冰有利于弥补能源短缺 | |
| D. | 用含甲酚的药皂除菌消毒,是利用酚类物质的强氧化性 |