题目内容
2.下列各组物质反应,既有气体最终又有沉淀生成的是( )①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2O2加到Ca(HCO3)2溶液中 ④浓硫酸铵溶液加入到浓氢氧化钡中.
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①③④ |
分析 ①Na与水反应生成NaOH和氢气,NaOH与氯化铁反应生成红褐色氢氧化铁沉淀;
②NaOH过量,生成偏铝酸盐;
③过氧化钠与水反应生成NaOH和氧气,且NaOH与Ca(HCO3)2溶液反应生成碳酸钙沉淀;
④浓硫酸铵溶液加入到浓氢氧化钡中,反应生成硫酸钡沉淀和氨气.
解答 解:①金属钠投入FeCl3溶液中,生成氢气和红褐色沉淀,故选;
②过量的NaOH溶液和明矾溶液,无现象,故不选;
③Na2O2加到Ca(HCO3)2溶液中,生成氧气和碳酸钙白色沉淀,故选;
④浓硫酸铵溶液加入到浓氢氧化钡中,生成氨气和硫酸钡白色沉淀,故选;
故选D.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表.
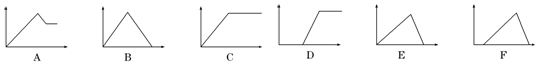

| 溶液 | 加入的物质 | 字母代号 |
| ①饱和石灰水 | 通过量CO2 | B |
| ②AlCl3溶液 | 通过量NH3 | C |
| ③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | A |
| ④AlCl3溶液 | 逐滴加NaOH溶液至过量 | E |
| ⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | F |
7.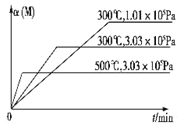 在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
 在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应. M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )| A. | x=2 | |
| B. | 平衡时,v 正 (B):v 逆 (C)=2:3 | |
| C. | 若保持容器容积不变,充入N,则C的物质的量减小 | |
| D. | 若保持容器容积不变,充入Q,反应①的平衡常数不变 |
11.下列操作或叙述正确的是( )
| A. | 用铂丝蘸取某盐溶液进行焰色反应,火焰呈黄色,说明该盐溶液含钠元素,一定不含钾元素 | |
| B. | 用小刀切下一小块金属钠,将剩余的钠再放回原试剂瓶 | |
| C. | 向某溶液中加入BaCl2溶液产生白色沉淀,再加稀盐酸沉淀不溶解,说明原溶液中一定含有SO42- | |
| D. | 向沸水中逐滴滴加1mol•L-1FeCl3溶液,并不断用玻璃棒搅拌,可制得Fe(OH)3胶体 |
12.在恒容密闭容器中,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,改变某一条件,下列说法正确的是( )
| A. | 增加H2的浓度,可提高CO2转化率 | |
| B. | 升高温度,可提高CO2转化率 | |
| C. | 升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 | |
| D. | 改用高效催化剂,可增大反应的平衡常数 |
 B-的结构示意图
B-的结构示意图 C+的电子式Na+
C+的电子式Na+