题目内容
现有一瓶物质是甲和乙的混合物,已知甲和乙的某些性质如下表所示:据此,将甲和乙相互分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 水中溶解性 |
| 甲 | -98℃ | 57.7℃ | 0.93g?cm-3 | 可溶 |
| 乙 | -84℃ | 97℃ | 0.90g?cm-3 | 可溶 |
| A、萃取法 | B、过滤法 |
| C、蒸馏法 | D、分液法 |
考点:物质的分离、提纯的基本方法选择与应用
专题:
分析:由表格中的数据可知,甲乙两种物质均溶于水,且沸点相差较大,可用蒸馏法分离.
解答:
解:两种物质均溶于水,不能用萃取、分液法、过滤法分离,由于沸点相差较大,可用蒸馏法分离,
故选C.
故选C.
点评:本题考查混合物的分离和提纯,为高频考点,侧重于考查学生的分析能力,题目难度不大,注意把握物质的性质的异同.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是( )
| A、用标准的NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液---浅红色 |
| B、用标准FeCl3溶液滴定KI溶液以测定其浓度:淀粉溶液---蓝色 |
| C、用标准酸性KmnO4溶液滴定Na2SO3溶液以测定其浓度:KmnO4溶液---紫红色 |
| D、利用“Ag++SCN═AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液---红色 |
在下列各组溶液中,离子一定能大量共存的是( )
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B、通入SO2气体后的溶液:Na+、Ca2+、K+、Cl- |
| C、0.1 mol?L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| D、1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
常温下,用0.1000mol?L-1 NaOH溶液分别滴定20.00mL 0.1000mol?L-1 盐酸和20.00mL 0.1000mol?L-1醋酸溶液,得到两条滴定曲线,如图所示,若以HA表示酸,下列说法正确的是( )
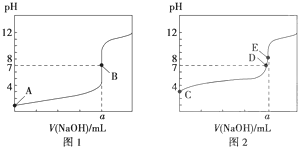

| A、滴定盐酸的曲线是图2 |
| B、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
| C、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-) |
| D、当0mL<V(NaOH)<20.00mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-) |
氯菊酯属低毒杀虫剂结构如图所示,下列有关氯菊酯说法正确的是( )
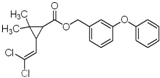

| A、分子式为C21H20Cl2O3 |
| B、不能使溴水褪色 |
| C、1mol氯菊酯与氢气加成最多消耗8 mol H2 |
| D、与NaOH溶液反应最多消耗4mol NaOH |
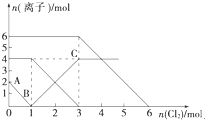 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2=2Fe3++2Br-2Fe3++2I-=2Fe2++I2,则下列有关说法中,不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3 mol |
| C、当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
下列说法不正确的是( )
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸,沉淀全部溶解 |
| D、向盛有FeCl2溶液的试管中滴加NaOH溶液,最终生成红褐色的Fe(OH)3沉淀 |




