题目内容
X、Y、Z、W是元素周期表前四周期中的常见元素.其相关信息如下表:
(1)Y位于元素周期表第 周期第 族;Y的原子半径比Z的 (填“大”或“小”).
(2)X的第一电离能比Y的 (填“大”或“小”); Y所在族各种元素的气态氢化物中沸点最低的是 (写化学式).X最低价气态氢化物与X最高价氧化物对应的水化物反应生成的化合物M的晶体类型是
(3)写出用惰性电极电解WSO4溶液的化学方程式 .
(4)在25℃、101KPa下,已知Z固体单质在Y2气体中完全燃烧毎转移1mol电子,恢复至原状态时放热279KJ,该反应的热化化学方程式是 .
| 元素 | 相关信息 |
| X | X的基态原子价电子排布式为:nsnnpn+1 |
| Y | Y原子的最外层电子数是次外层的三倍 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(2)X的第一电离能比Y的
(3)写出用惰性电极电解WSO4溶液的化学方程式
(4)在25℃、101KPa下,已知Z固体单质在Y2气体中完全燃烧毎转移1mol电子,恢复至原状态时放热279KJ,该反应的热化化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是元素周期表前四周期中的常见元素,X的基态原子价电子排布式为:nsnnpn+1,s能级上最多排2个电子,且p能级上还有电子,所以n为2,则x的基态原子最外层电子排布式为:2s22p3,所以X基态原子核外有7个电子,则X是N元素;Y的基态原子Y原子的最外层电子数是次外层的三倍,所以y基态原子核外有8个电子,则Y是O元素;Z存在质量数为27,中子数为14的核素,则其质子数是13,所以Z是Al元素;W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体,则蓝色固体是氢氧化铜,所以W是Cu,据此答题;
解答:
解:X、Y、Z、W是元素周期表前四周期中的常见元素,X的基态原子价电子排布式为:nsnnpn+1,s能级上最多排2个电子,且p能级上还有电子,所以n为2,则x的基态原子最外层电子排布式为:2s22p3,所以X基态原子核外有7个电子,则X是N元素;Y的基态原子Y原子的最外层电子数是次外层的三倍,所以y基态原子核外有8个电子,则Y是O元素;Z存在质量数为27,中子数为14的核素,则其质子数是13,所以Z是Al元素;W元素最高价氧化物对应的水化物是一种不溶于水的蓝色固体,则蓝色固体是氢氧化铜,所以W是Cu,
(1)通过以上分析知,Y是O元素,氧元素位于第二周期第ⅥA族,Z是Al元素,铝原子比氧原子多一个电子层,所以铝的原子半径大于氧,
故答案为:二;ⅥA;小;
(2)由于氮原子最外层p轨道电子处于半满状态,是一种稳定结构,所以氮的第一电离能比Y氧的大; 在氧族元素中,由于水分子之间有氢键存在,所以Y所在族各种元素的气态氢化物中沸点最低的是H2S,X最低价气态氢化物为氨气与X最高价氧化物对应的水化物为硝酸反应生成的化合物M是硝酸铵,是离子晶体,
故答案为:大;H2S;离子晶体;
(3)用惰性电极电解CuSO4溶液的化学方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(4)在25℃、101KPa下,已知铝在O2中完全燃烧毎转移1mol电子,恢复至原状态时放热279KJ,当有4mol铝参加反应,即转移12mol电子时,放热为3348KJ的热,所以该反应的热化化学方程式为4Al(s)+3O2(g)=2Al2O3(s),△H=-3348KJ/mol,
故答案为:4Al(s)+3O2(g)=2Al2O3(s),△H=-3348KJ/mol;
(1)通过以上分析知,Y是O元素,氧元素位于第二周期第ⅥA族,Z是Al元素,铝原子比氧原子多一个电子层,所以铝的原子半径大于氧,
故答案为:二;ⅥA;小;
(2)由于氮原子最外层p轨道电子处于半满状态,是一种稳定结构,所以氮的第一电离能比Y氧的大; 在氧族元素中,由于水分子之间有氢键存在,所以Y所在族各种元素的气态氢化物中沸点最低的是H2S,X最低价气态氢化物为氨气与X最高价氧化物对应的水化物为硝酸反应生成的化合物M是硝酸铵,是离子晶体,
故答案为:大;H2S;离子晶体;
(3)用惰性电极电解CuSO4溶液的化学方程式为2CuSO4+2H2O
| ||
故答案为:2CuSO4+2H2O
| ||
(4)在25℃、101KPa下,已知铝在O2中完全燃烧毎转移1mol电子,恢复至原状态时放热279KJ,当有4mol铝参加反应,即转移12mol电子时,放热为3348KJ的热,所以该反应的热化化学方程式为4Al(s)+3O2(g)=2Al2O3(s),△H=-3348KJ/mol,
故答案为:4Al(s)+3O2(g)=2Al2O3(s),△H=-3348KJ/mol;
点评:本题主要考查了元素周期表、元素周期律、电解池、热化学方程式等知识,中等难度,元素推断是解题的关键,答题时注意基础知识的灵活运用.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
中和滴定是一种操作简单,准确度高的定量分析方法.实际工作中也可利用物质的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是( )
| A、用标准的NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液---浅红色 |
| B、用标准FeCl3溶液滴定KI溶液以测定其浓度:淀粉溶液---蓝色 |
| C、用标准酸性KmnO4溶液滴定Na2SO3溶液以测定其浓度:KmnO4溶液---紫红色 |
| D、利用“Ag++SCN═AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液---红色 |
在下列各组溶液中,离子一定能大量共存的是( )
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B、通入SO2气体后的溶液:Na+、Ca2+、K+、Cl- |
| C、0.1 mol?L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| D、1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
下列说法不正确的是( )
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解,再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸,沉淀全部溶解 |
| D、向盛有FeCl2溶液的试管中滴加NaOH溶液,最终生成红褐色的Fe(OH)3沉淀 |
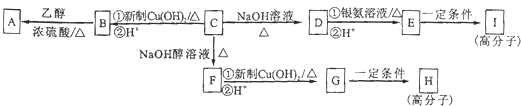
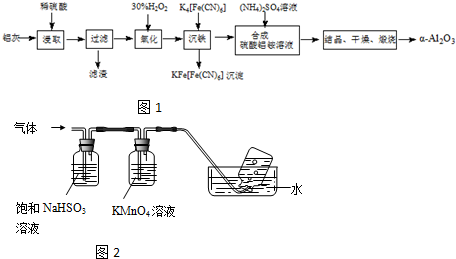
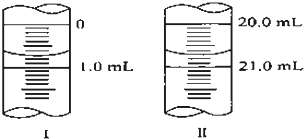 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下: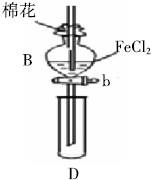 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下: