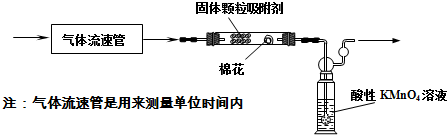
题目内容
2.冬天用煤炉取暖时要预防发生一氧化碳中毒事故.一氧化碳的产生主要是因为煤炉中发生了以下反应:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,试分析下列有关叙述中确的是( )| A. | C在O2充足时,发生的反应主要是放热反应 | |
| B. | 煤燃烧时吹入的氧气越多越好 | |
| C. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO这一反应属于吸热反应 | |
| D. | 煤燃烧时,反应物自身总能量高于生成物总能量,所以放出热量 |
分析 A.燃烧都是放热反应;
B.煤燃烧时吹入的氧气越多,气体流通带走的热量多;
C.碳与二氧化碳的反应是吸热反应;
D.煤燃烧为放热反应,反应物总能量和高于生成物总能量和.
解答 解:A.木炭在氧气中的燃烧,属于燃烧反应,是放热反应,故A正确;
B.煤燃烧时吹入的氧气越多,气体流通带走的热量越多,所以不是煤燃烧时吹入的氧气越多越好,故B错误;
C.碳与二氧化碳的反应是吸热反应,故C正确;
D.当反应物的能量高于生成物总能量时,反应是放热反应,煤燃烧时,反应物自身总能量高于生成物总能量,所以放出热量,故D正确;
故选ACD.
点评 本题考查化学反应能量的变化,题目难度不大,注意有关概念的理解,学习中注意基础知识的积累.

练习册系列答案
相关题目
13.下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 利用A装置,若A为浓醋酸、B为碳酸钠(粉状)、C为苯酚钠溶液,一定能验证醋酸、碳酸、苯酚酸性的强弱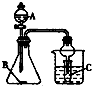 | |
| B. | 利用B装置可以完成乙酸乙酯制取实验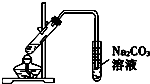 | |
| C. | 利用C装置可以完成石油蒸馏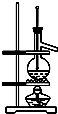 | |
| D. | 利用D装置可以完成实验室制乙烯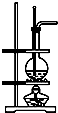 |
10.某有机物的分子式为C9H12,其属于芳香烃的同分异构体有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
17.某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线.当玻璃被击碎时,与金属线相连的警报系统就会立即报警.“防盗玻璃”能报警是利用了金属的( )
| A. | 延展性 | B. | 导电性 | C. | 弹性 | D. | 导热性 |
7.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,且原子核外L层电子数分别为0、5、8、8、8,Y元素与其他元素不在同一主族,Z、W、Q元素的最高价氧化物对应水化物均可发生反应.下列说法正确的是( )
| A. | 离子半径:Q>W>Z | |
| B. | Q的氢化物的水溶液一定具有强酸性 | |
| C. | X、Y、Q可同时存在同一离子化合物中 | |
| D. | 单质的沸点:W>Q>Z |
4.某同学用Na2CO3配制0.10mol/L Na2CO3(aq)的过程如图所示.你认为该同学的错误有( )

| A. | ①⑤⑥ | B. | ②④⑦ | C. | ①⑥⑦ | D. | ⑤⑥⑦ |
 硝基还原为氨基:
硝基还原为氨基: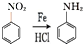
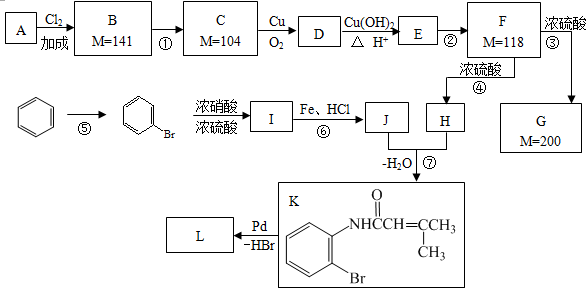
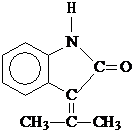 .
.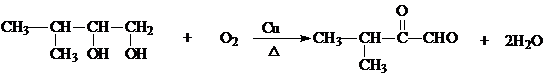 .
. .
.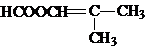 .
.