题目内容
已知一定条件下二氧化碳气体的溶解平衡CO2(g)?CO2(aq)△H=-19.75kJ/mol,为增大CO2气体在水中的溶解度,下列方法一定可行的是( )
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:为了增大二氧化碳气体在水中的溶解度,应使平衡向正反应方向移动,注意温度和压强对平衡移动的影响.
解答:
解:对平衡体系CO2 (g)?CO2(aq)△H=-19.75kJ?mol-1,该反应放热,为增大二氧化碳气体在水中的溶解度,应降低温度,增大压强,可使平衡向正反应方向移动,所以为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应降温增压,
故选D.
故选D.
点评:本题考查外界条件对平衡移动的影响,题目难度不大,注意把握影响平衡的移动的因素.

练习册系列答案
相关题目
下列说法正确的是( )
| A、苯滴入溴水中振荡后水层接近无色,发生了化学反应 |
| B、乙烯和乙烷都可以与氢气发生加成反应 |
| C、烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于料酒中的乙醇和食醋中的乙酸反应生成的乙酸乙酯 |
| D、乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 |
CO2转化成有机物实现碳循环,是解决温室效应的有效途径之一,此反应化学平衡常数的表达式为:K=
且温度升高,K值变小.下列说法正确的是( )
| c(CH3OH).c(H2O) |
| c3(H2).c(CO2) |
| A、该反应的化学方程式为3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H>O |
| B、在恒温、恒容的密闭容器中,混合气体的密度不再改变时,该反应一定达到平衡状态 |
| C、在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大 |
| D、平衡时,其他条件不变,使用催化剂有利用于CO2的转化 |
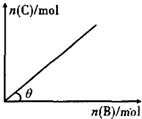 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
下列说法正确的是( )
| A、含5个碳原子的有机物,每个分子中最多可形成4个C-C单键 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、可用新制的氢氧化铜悬浊液检验淀粉是否水解完全 |
| D、煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
下列关于杂化轨道的叙述中,不正确的是( )
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 |
| C、杂化轨道理论与价层电子互斥理论都可以分析分子的空间构型 |
| D、[Cu(NH3)4]2+和CH4两个微粒中中心原子Cu和C都是通过sp3杂化轨道成键 |
根据有关的概念,推断下列说法中正确的是( )
| A、元素的非金属性越强,单质的活泼性一定越强 |
| B、分子晶体中分子间的作用力越大,分子越稳定 |
| C、离子晶体发生状态变化时,一定会破坏离子键 |
| D、分子中含有两个氢原子的酸,一定就是二元酸 |
下列说法不正确的是( )
| A、煤炭经气化,液化和干馏等过程,可获得清洁能源和重要的化工原料 |
| B、漂白粉和漂粉精不仅可以漂白棉,麻,纸张,还可做环境消毒剂 |
| C、Fe3O4俗称铁红,常做红色油漆和涂料 |
| D、蛋白质、淀粉、纤维素均属于天然有机高分子化合物 |
下列化学反应对应的离子方程式正确的是( )
| A、Cl2与H2O的反应:Cl2+H2O=2H++Cl-+ClO- |
| B、FeCl3溶液与KI溶液跑反应:Fe3++2I-=Fe2++I2 |
| C、Cu与稀硝酸的反应:Cu+2H++NO3-=Cu2++NO↑+H2O |
| D、Al2O3与NaOH溶液的反应:Al2O3+2OH-+3H2O=2[Al(OH)4]- |