题目内容
13.下列实验中,所选装置不合理的是( )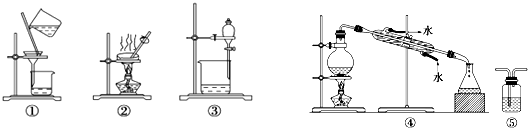
| A. | 用CCl4提取碘水中的碘,选③ | |
| B. | 用KMnO4溶液检验CH4是否含有C2H4,选⑤ | |
| C. | 粗盐提纯,选①和② | |
| D. | 石油的分馏,选④ |
分析 A.用CCl4提取碘水中的碘,采用萃取和分液的方法;
B.乙烯能使酸性高锰酸钾溶液褪色而甲烷不能使酸性高锰酸钾溶液褪色;
C.粗盐提纯采用过滤、蒸发的方法;
D.石油分馏采用蒸馏方法,需要用温度计测量馏分温度.
解答 解:A.四氯化碳能萃取碘水中的碘,所以用CCl4提取碘水中的碘时,采用萃取和分液的方法,则选择③装置,故A正确;
B.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色,所以可以用⑤检验甲烷中是否含有乙烯,故B正确;
C.粗盐提纯采用过滤、蒸发的方法,所以选择①②装置,故C正确;
D.石油分馏采用蒸馏方法,需要用温度计测量馏分温度,该实验中没有温度计,故D错误;
故选D.
点评 本题以物质分离提纯为载体考查化学实验方案评价,为高频考点,明确实验原理及物质性质、仪器用途是解本题关键,知道实验室中常用仪器的用途,易错选项是D,侧重考查学生实验操作及评价,题目难度不大.

练习册系列答案
相关题目
9.常温下,下列有关叙述正确的是( )
| A. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| C. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
1.现有苯甲酸、苯酚溶于乙醇所得的混合液,某同学设计方案分离三种物质,并检验其中的某些离子和物质.
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚>HCO3-
(2)部分物理参数如下:
供选择试剂:10%氢氧化钠溶液、0.1mol/L盐酸、0.1mol/LNa2CO3、0.1mol/L NaHCO3、浓溴水、生石灰、0.1mol/L FeCl3、0.1mol/L BaCl2、CO2、0.1mol/L溴水、澄清石灰水
(1)分离物质流程如下:
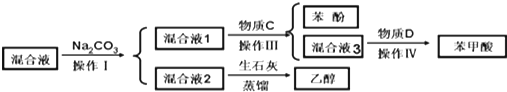
物质C是CO2,操作IV是过滤.
(2)操作III发生的主要化学反应方程式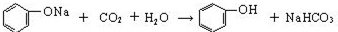 .
.
(3)混合液2中加入生石灰的原因是生石灰与混合液2中的水反应,生成氢氧化钙溶液,并放出热量,便于乙醇从混合物中蒸馏出.
(4)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱.完成下列各步实验及实验现象和结论.
(5)称取2.0g苯甲酸和苯酚的混合固体溶于足量乙醇中,滴加足量饱和NaHCO3溶液,测得放出的CO2(标准状况下,不考虑CO2溶于水)为33.6mL,则苯甲酸的质量分数为$\frac{\frac{0.036L}{22.4L/mol}×122g/mol}{2g}$×100%,(只列式,不计算),结果为9.2%.(结果保留1位小数)(苯甲酸的相对分子质量为122,苯酚相对分子质量为94)
已知:(1)酸性强弱:HCl>苯甲酸>H2CO3>苯酚>HCO3-
(2)部分物理参数如下:
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 苯甲酸 | 1.2659 | 122.13 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
| 苯酚 | 1.07 | 40.6 | 181.9 | 易溶于乙醇、乙醚,65℃以上能与水互溶 |
| 乙醇 | 0.79 | -114.3 | 78.5 | 与水混溶,可混溶于醚、氯仿、甘油等多数有 机溶剂 |
(1)分离物质流程如下:

物质C是CO2,操作IV是过滤.
(2)操作III发生的主要化学反应方程式
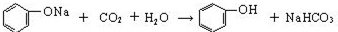 .
.(3)混合液2中加入生石灰的原因是生石灰与混合液2中的水反应,生成氢氧化钙溶液,并放出热量,便于乙醇从混合物中蒸馏出.
(4)该同学检验混合液1中是否含有苯酚和NaHCO3,以证明酸性的强弱.完成下列各步实验及实验现象和结论.
| 实验步骤 | 现象和结论 |
| ①取少量混合液1于试管,滴加BaCl2, 振荡,静置 | 产生白色沉淀,BaCO3 |
| ②取少量步骤①上层清夜于试管,滴加0.1mol/L盐酸再将产生的气体通入澄清石灰水中 | 澄清石灰水变浑浊 说明混合液1含有HCO3- |
| ③另取少量混合液1于试管,滴加0.1mol/L FeCl3溶液,振荡 | 溶液不显紫色, 说明混合液1不含有酚羟基 |
8.下列说法正确的是( )
| A. | 4mol/LNaCl溶液与2mol/LNa2SO4溶液混合后,c(Na+)为4 mol/L | |
| B. | 240 g NaCl溶液中溶有40 g NaCl,该温度下NaCl的溶解度为20g | |
| C. | 22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mo1/L | |
| D. | 把5 g胆矾(CuSO4?5H2O)溶于45 g水中,所得溶液溶质的质量分数为10% |
2.某温度时,浓度都是1mol/L的两种气体X2和Y2在密闭容器中反应生成气体Z,达到平衡后C(X2)为0.4mol/L,C(Y2)为0.8mol/L,生成C(Z)为0.4mol/L,则该反应方程式可表示为( )
| A. | X2+2Y2?2XY2 | B. | 3X2+Y2?2X3Y | C. | X2+3Y2?2XY3 | D. | 2X2+2Y2?2X2Y |
3.关于电解饱和食盐水溶液,下列叙述正确的是( )
| A. | 电解时在阳极得到金属钠 | |
| B. | 在阴极附近的溶液中滴入酚酞溶液,溶液呈红色 | |
| C. | 在阴极附近有黄绿色的气体产生,并能使湿润淀粉碘化钾试纸变蓝 | |
| D. | 电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |


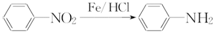 (苯胺,易被氧化)
(苯胺,易被氧化)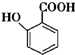 不可选用的试剂有c(填标号).
不可选用的试剂有c(填标号).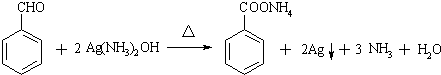 ;若F为高分子化合物,则反应⑦的化学方程式为n
;若F为高分子化合物,则反应⑦的化学方程式为n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$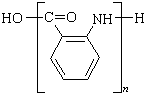 +(n-1)H2O.
+(n-1)H2O.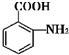 的合成路线流程图(无机试剂任用).合成路线流程图示例如下(已知
的合成路线流程图(无机试剂任用).合成路线流程图示例如下(已知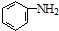 容易被氧化剂氧化):
容易被氧化剂氧化):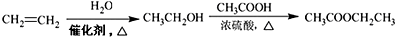 .
.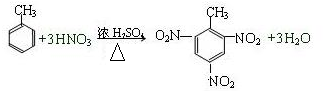
 .
.