题目内容
15.下列热化学方程式表达正确的是( )| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | KOH(aq)+HNO3(aq)═KNO3+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1(反应热) |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C.热化学方程式需要标注物质聚集状态和对应反应的焓变;
D.标注物质聚集状态和对应反应的焓变写出的为热化学方程式;
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,选项中生成的水为气体,不是稳定氧化物,故A错误;
B.中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量,酸碱中和反应为放热反应,焓变为负值,硝酸钾状态未标注,故B错误;
C.热化学方程式需要标注物质聚集状态和对应反应的焓变,S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热),符合热化学方程式书写,故C正确;
D.选项中未标注物质聚集状态,不是热化学方程式,故D错误;
故选C.
点评 本题考查了热化学方程式书写方法,主要是燃烧热、中和热概念的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.以下比较镁、铝金属性强弱的实验方案不合理的是( )
| A. | 镁、铝分别与热水反应 | |
| B. | 镁、铝分别与盐酸反应 | |
| C. | 氯化镁溶液、氯化铝溶液分别与氢氧化钠溶液反应 | |
| D. | 将镁-铝-氢氧化钠溶液设计为原电池 |
3.下列分子属于手性分子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
10.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中.常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
4.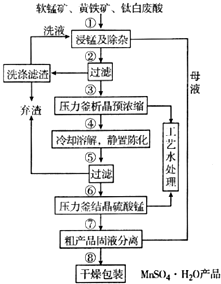 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上). (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.
实际生产过程中,①中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去;②中调节pH为3.5时,沉淀的主要成分是Fe(OH)3.
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上).
 (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.| 化学式 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
5.下列关于有机物因果关系的叙述中,完全正确的一组是( )
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯和乙烯都能与溴水发生加成反应 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯一定条件下都能与水反应 | 两者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |
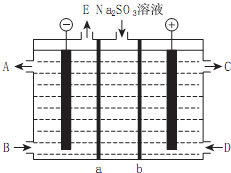
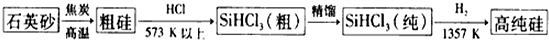
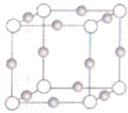 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.