题目内容
7.将Cl2通入200mL0.5mol•L-1氢氧化钾溶液中,二者恰好完全反应得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量之比是1:2,则通入的Cl2在标准状况下的体积为( )| A. | 0.56L | B. | 1.68L | C. | 2.24L | D. | 1.12L |
分析 由Cl2与KOH恰好反应生成KCl、KClO、KClO3,结合n(K)=n(Cl)可知n(Cl2)=n(KOH)=$\frac{1}{2}$×0.2L×0.5mol/L=0.05mol,结合V=nVm计算.
解答 解:由Cl2与KOH恰好反应生成KCl、KClO、KClO3,结合n(K)=n(Cl)可知n(Cl2)=n(KOH)=$\frac{1}{2}$×0.2L×0.5mol/L=0.05mol,通入的Cl2在标准状况下的体积为0.05mol×22.4L/mol=1.12L,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及守恒法为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
17.化学是一门以实验为基础的学科.下列实验操作正确的是( )
| A. |  检查装置气密性 | B. |  量取 | ||
| C. |  稀释浓硫酸 | D. |  萃取时振荡混合液 |
18.下列有关热化学方程式的叙述正确的是( )
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
15.用NA表示阿伏加德罗常数的教值,下列说法正确的是( )
| A. | 1Ll.00mol•L-1NaCl溶浓中NaCl分子数为NA | |
| B. | 标准状况下,2.24L由N2和O2组成的混合气体中所含的原子数为0.1NA | |
| C. | 常温下,0.1molCl2溶于水时,转移的电子效是0.1NA | |
| D. | 0.lmolFe与过量稀HNO3反应时,转移的电子教为0.3NA |
2.a mol O2和a mol O3相比较一定相同的是( )
| A. | 体积 | B. | 原子数 | C. | 分子数 | D. | 质量 |
12.下列有关化学用语表达正确的是( )
| A. | 35Cl-和37Cl-离子结构示意图均可以表示为: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: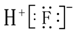 | |
| D. | 质子数为92、中子数为146的U原子:14692U |
19.下列有关化学用语使用正确的是( )
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 氦气的结构式:He-He | |
| D. | 原子核内有l7个中子的氯原子:${\;}_{17}^{35}$Cl |
16.如图所示的实验装置不能完成实验目的是( )
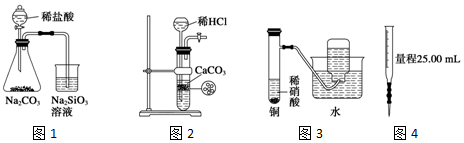

| A. | 图1为证明非金属性强弱:Cl>C>Si | |
| B. | 图2为制备少量CO2并控制反应 | |
| C. | 图3为制备并收集少量NO气体 | |
| D. | 图4量取0.10mol•L-1 KOH溶液20.00mL |