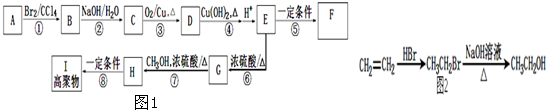
题目内容
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、气态氢化物稳定性:Y>T |
| B、五种元素中原子半径最大的是Z |
| C、R位于元素周期表中第二周期第ⅣA族 |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由短周期元素R、T、X、Y、Z在元素周期表的相对位置,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则x+x+(x+1)×2+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S,然后结合元素性质及周期律来解答.
解答:
解:A、非金属性T>Y,则气态氢化物稳定性:Y<T,故A错误;
B、电子层越多,原子半径越大,同周期从左向右原子半径在减小,则五种元素中原子半径最大的是X,故B错误;
C、R为C,位于元素周期表中第二周期第ⅣA族,故C正确;
D、Z为S,最高价为+6价,Z元素的最高价氧化物对应的水化物的化学式为H2ZO4,故D错误;
故选C.
B、电子层越多,原子半径越大,同周期从左向右原子半径在减小,则五种元素中原子半径最大的是X,故B错误;
C、R为C,位于元素周期表中第二周期第ⅣA族,故C正确;
D、Z为S,最高价为+6价,Z元素的最高价氧化物对应的水化物的化学式为H2ZO4,故D错误;
故选C.
点评:本题考查位置、结构、性质的关系及应用,为高频考点,元素的推断为解答的关键,注意利用元素的位置及最外层电子数推断元素,把握元素周期律即可解答,题目难度中等.

练习册系列答案
相关题目
使5.6LCO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),4.48L气体的质量是( )
| A、8.8 g |
| B、8.2 g |
| C、6.4 g |
| D、11g |
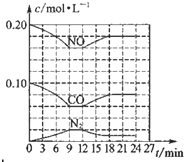 将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )
将0.20mol NO和0.1mol CO充入一个容积恒定为1L的密闭容器中发生反应:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H<0在不同条件下,反应过程中部分物质的浓度变化如图所示.下列说法正确的是( )| A、容器内的压强不发生变化说明该反应达到平衡 |
| B、当向容器中再充入0.20 mol NO时,平衡向正反应方向移动,K增大 |
| C、第12 min时改变的反应条件为减小压强 |
| D、向该容器内充入He气,容器内气体压强增大,所以反应速率增大 |
下列反应中,有沉淀产生且不会消失的是( )
| A、向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
| B、将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
| C、向AlCl3溶液中逐滴滴入稀硫酸 |
| D、将氨水逐滴滴入硝酸银溶液中,直至过量 |
0.75molRO32- 共有30mol电子,则R在元素周期表中的位置是( )
| A、.第二周期ⅤA族 |
| B、.第三周期ⅣA族 |
| C、.第二周期ⅥA族 |
| D、.第三周期Ⅶ族 |