题目内容
6.能正确表示下列反应的离子方程式是( )| A. | 用石墨作电极电解CuCl2溶液:2Cl-+2H2O$\stackrel{电解}{→}$2OH-+Cl2↑+H2↑ | |
| B. | 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-═SO42-+Cl-+H2O | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3+H2O |
分析 A.用石墨作电极电解CuCl2溶液生成铜和氯气;
B.二者反应生成硫酸钡、氢氧化铝和一水合氨;
C.少量二氧化硫通入次氯酸钠溶液,发生氧化还原反应生成硫酸根离子和氯离子;
D.Ca(HCO3)2溶液与过量NaOH溶液反应,生成碳酸钙沉淀和碳酸钠.
解答 解:A.用石墨作电极电解CuCl2溶液生成铜和氯气,电解方程式为2Cl-+Cu2+$\stackrel{电解}{→}$Cu+Cl2↑,故A错误;
B.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合,生成硫酸钡、氢氧化铝和一水合氨,离子方程式为NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O,故B错误;
C.少量二氧化硫通入次氯酸钠溶液,发生氧化还原反应生成硫酸根离子和氯离子,离子方程式为SO2+ClO-+2OH-═SO42-+Cl-+H2O,故C正确;
D.Ca(HCO3)2溶液与过量NaOH溶液反应,生成碳酸钙沉淀和碳酸钠,离子方程式为Ca2++2HCO3-+2OH-═CaCO3+CO32-+2H2O,故D错误.
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,侧重考查学生的分析能力,注意与量有关的离子反应及与氧化还原有关的离子反应均为解答的难点,题目难度较大.

练习册系列答案
相关题目
16.X、Y、Z为短周期元素,电子层数相同,原子序数依次增大,三种元素的最高价氧化物对应的水化物两两之间均可发生反应.下列说法中正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X的最高价氧化物对应的水化物中只含有共价键 | |
| C. | X、Z形成的化合物一定为离子化合物 | |
| D. | 工业上常用Y的氯化物为原料制取单质Y |
17.下列做法不符合绿色化学原则的是( )
| A. | 大力开发太阳能,尽量减少化石燃料的使用 | |
| B. | 对废旧电池进行回收利用 | |
| C. | 农作物秸秆露天焚烧以制肥料 | |
| D. | 汽车使用尾气净化装置,减少有害气体排放 |
14.化学与社会密切相关,下列说法错误的是( )
| A. | 用硫酸可以洗去锅炉水垢 | |
| B. | 用加热的方法可以杀死流感病毒 | |
| C. | 食盐既可做调味品,也可以做防腐剂 | |
| D. | 洗涤棉制品可以使用弱碱性洗涤剂或肥皂 |
11.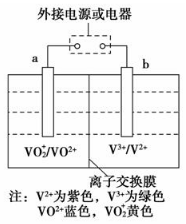 某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
 某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )
某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性.充电时右槽溶液颜色由绿色变为紫色.下列叙述正确的是( )| A. | 放电时,H+从左槽迁移进右槽 | |
| B. | 放电过程中,左槽溶液颜色由黄色变为蓝色 | |
| C. | 充电时,b极接直流电源正极,a极接直流电源负极 | |
| D. | 充电过程中,a极的电极反应式为:VO2++2H++e-═VO2++H2O |
4.下列说法中正确的是( )
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 分子间作用力越大,物质的熔、沸点越高 | |
| C. | 相对分子质量越大,其分子间作用力越大 | |
| D. | 分子间只存在范德华力 |

 .
.