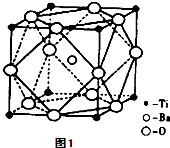
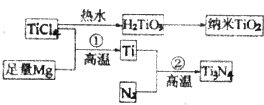
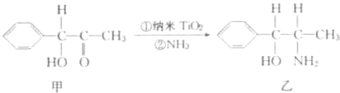
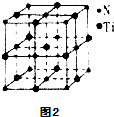
题目内容
氯水中存在如下平衡:Cl2+H2O?HCl+HClO.现向氯水中加入下列物质:请回答下列问题:
(1)加入少量CaCO3(s),发生反应的离子方程式表示为 ,平衡向 移动(填“正向”、“逆向”或“不”,下同),HClO的浓度 (填“增大”、“减小”或“不变”,下同).
(2)加入少量NaCl(s),平衡 移动,HClO的浓度 .
(3)加入少量NaOH(s),平衡 移动,HClO的浓度 .
(4)加入少量浓品红试液,实验现象为 ,HCl的物质的量 .
(5)加蒸馏水稀释,HClO的浓度 .
(1)加入少量CaCO3(s),发生反应的离子方程式表示为
(2)加入少量NaCl(s),平衡
(3)加入少量NaOH(s),平衡
(4)加入少量浓品红试液,实验现象为
(5)加蒸馏水稀释,HClO的浓度
考点:化学平衡的影响因素
专题:化学平衡专题
分析:反应:Cl2+H2O?HCl+HClO达到平衡后,HCl为强酸,HClO为弱酸,酸性比碳酸弱,依据化学平衡影响因素和平衡移动原理分析解答该题.
解答:
解:(1)加入少量CaCO3(s),HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,发生反应的离子方程式表示为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;正向;增大;
(2)加入少量NaCl(s),溶解后氯离子浓度增大,平衡逆向进行,HClO浓度减小,故答案为:逆向;减小;
(3)加入少量NaOH(s),NaOH和HCl、HClO都反应,平衡正向进行,HClO浓度减小,故答案为:正向;减小;
(4)加入少量浓品红试液次氯酸具有氧化性氧化品红红色褪去,消耗次氯酸,平衡正向进行,氯化氢物质的量增大,故答案为:褪色;增大;
(5)加入水,溶液体积增大,虽然平衡向正反应方向移动,但溶液浓度反而降低,次氯酸浓度减小,故答案为:减小.
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;正向;增大;
(2)加入少量NaCl(s),溶解后氯离子浓度增大,平衡逆向进行,HClO浓度减小,故答案为:逆向;减小;
(3)加入少量NaOH(s),NaOH和HCl、HClO都反应,平衡正向进行,HClO浓度减小,故答案为:正向;减小;
(4)加入少量浓品红试液次氯酸具有氧化性氧化品红红色褪去,消耗次氯酸,平衡正向进行,氯化氢物质的量增大,故答案为:褪色;增大;
(5)加入水,溶液体积增大,虽然平衡向正反应方向移动,但溶液浓度反而降低,次氯酸浓度减小,故答案为:减小.
点评:本题考查化学平衡的影响,题目难度不大,注意加入水,溶液体积增大的倍数要大于HClO物质的量增大的倍数,HClO浓度降低,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、过量的Fe粉与氯气和氯水反应所得氯化物相同 |
| B、Na、Mg、Al分别与不足量的稀硫酸反应所得溶液均呈中性 |
| C、铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3充分反应过滤除去 |
| D、常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀 |
下列反应中,不是氧化还原反应的是( )
A、H2+Cl2
| ||||
| B、Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||||
C、2H2O
| ||||
| D、CuO+2HNO3═Cu(NO3)2+H2O |
 (1)键线式
(1)键线式 表示的分子式
表示的分子式