题目内容
在某温度下,将H2和I2各0.1mol的气态混合物充入2L的密闭容器中,充分反应,达到平衡后,测得c(HI)=0.02mol/L.
(1)求该反应的平衡常数?
(2)在上述温度下,该容器中若通入H2和I2各4.0mol的气态混合物,求达到化学平衡状态时各物质的浓度?
(1)求该反应的平衡常数?
(2)在上述温度下,该容器中若通入H2和I2各4.0mol的气态混合物,求达到化学平衡状态时各物质的浓度?
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)在某温度下,将H2和I2各0.1mol的气态混合物充入2L的密闭容器中,达到平衡时,测得c(HI)=0.02mol/L,则
H2(g)+I2(g) 2HI(g)
2HI(g)
起始时各物质的浓度(mol?L-1) 0.05 0.05 0
各物质的浓度变化量(mol?L-1) 0.01 0.01 0.02
平衡时各物质的浓度(mol?L-1) 0.04 0.04 0.02
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
H2(g)+I2(g)
 2HI(g)
2HI(g)起始时各物质的浓度(mol?L-1) 0.05 0.05 0
各物质的浓度变化量(mol?L-1) 0.01 0.01 0.02
平衡时各物质的浓度(mol?L-1) 0.04 0.04 0.02
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
解答:
解:(1)在某温度下,将H2和I2各0.1mol的气态混合物充入2L的密闭容器中,达到平衡时,测得c(HI)=0.02mol/L,则
H2(g)+I2(g) 2HI(g)
2HI(g)
起始时各物质的浓度(mol?L-1) 0.05 0.05 0
各物质的浓度变化量(mol?L-1) 0.01 0.01 0.02
平衡时各物质的浓度(mol?L-1) 0.04 0.04 0.02
(1)平衡时c(H2)=c(I2)=0.04mol/L,c(HI)=0.02mol/L,
则K=
=
=0.25;
答:该反应的平衡常数为0.25;
(2)此温度下,若通入H2和I2各4.0mol的气态混合物,起始量分别是c(H2)=2mol/L、c(I2)=2mol/L,反应前后气体体积不变,达到平衡后,氢气转化率和(1)平衡状态下的转化率相同为
×100%=20%,
H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol?L-1) 2 2 0
各物质的浓度变化量(mol?L-1) 2×20% 2×20% 2×20%×2
平衡时各物质的浓度(mol?L-1) 2-0.4 2-0.4 0.8
所以平衡时c(HI)=0.8mol?L-1,c(H2)=1.6mol/L;c(I2)=1.6mol/L;
答:化学平衡时HI(g)的平衡浓度为0.8mol/L.I2,H2平衡浓度都为1.6mol/L.
H2(g)+I2(g)
 2HI(g)
2HI(g)起始时各物质的浓度(mol?L-1) 0.05 0.05 0
各物质的浓度变化量(mol?L-1) 0.01 0.01 0.02
平衡时各物质的浓度(mol?L-1) 0.04 0.04 0.02
(1)平衡时c(H2)=c(I2)=0.04mol/L,c(HI)=0.02mol/L,
则K=
| c2(HI) |
| c(H2)?c(I2) |
| 0.022 |
| 0.04×0.04 |
答:该反应的平衡常数为0.25;
(2)此温度下,若通入H2和I2各4.0mol的气态混合物,起始量分别是c(H2)=2mol/L、c(I2)=2mol/L,反应前后气体体积不变,达到平衡后,氢气转化率和(1)平衡状态下的转化率相同为
| 0.01 |
| 0.05 |
H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol?L-1) 2 2 0
各物质的浓度变化量(mol?L-1) 2×20% 2×20% 2×20%×2
平衡时各物质的浓度(mol?L-1) 2-0.4 2-0.4 0.8
所以平衡时c(HI)=0.8mol?L-1,c(H2)=1.6mol/L;c(I2)=1.6mol/L;
答:化学平衡时HI(g)的平衡浓度为0.8mol/L.I2,H2平衡浓度都为1.6mol/L.
点评:本题考查了化学平衡的三段式计算应用,平衡常数的计算分析应用,注意反应前后气体体积不变,同比例增大反应物的量平衡不动,平衡原平衡是等效平衡,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、工业制漂白粉的反应:Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O |
| C、用铜作电极电解饱和食盐水:2Cl-+2H2O=2OH-+Cl2↑+H2↑ |
| D、铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O |
若阿伏加德罗常数为NA,下列说法不正确的是( )
| A、标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA |
| B、56g铁和足量氯气完全反应,转移的电子数为3NA |
| C、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| D、1mol FeCl3完全转化为Fe(OH)3胶体后形成的胶粒数为NA |

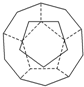 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图.
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图. A~E五种物质间的相互转化关系如图所示,其中A为单质,B为淡黄色的固体.试推断:(用化学式表示)
A~E五种物质间的相互转化关系如图所示,其中A为单质,B为淡黄色的固体.试推断:(用化学式表示)