题目内容
9. 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解,在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如图:步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液.
步骤2:将装置A 中导气管换成橡皮塞.向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶.
(1)装置B 的烧杯中应加入的溶液是氢氧化钠溶液;冷凝管中冷却水从a(填“a”或“b”)口进水.
(2)A中多孔球泡的作用是增大气体与溶液的接触面积,加快气体的吸收速率;
(3)写出步骤2中发生反应的化学方程式NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2;
(4)步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止防止氧气将产物氧化;
(5)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g.[M(NaHSO2•HCHO•2H2O)=154g/mol]
①如何检验沉淀是否洗净取最后一次洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若无白色沉淀,说明已经洗净,若有白色沉淀,则未洗净.
②则所制得的产品的纯度为77%.
分析 (1)装置B吸收未反应的二氧化硫等;采取逆流原理通入冷凝水;
(2)多孔球泡可以增大气体与液体的接触面积;
(3)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀;
(4)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化;
(5)①洗涤不干净,会附着氯化钡,检验最后一次洗涤液是否含有氯离子判断;
②由NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO、NaHSO4+BaCl2=BaSO4↓+HCl+NaCl,可得关系式:NaHSO2•HCHO•2H2O~BaCl2,根据关系式计算
解答 解:(1)装置B吸收未反应的二氧化硫等,可以用氢氧化钠溶液吸收;采取逆流原理通入冷凝水,可以充分冷却,即从a口中通入冷凝水,
故答案为:氢氧化钠溶液;a;
(2)多孔球泡可以增大气体与液体的接触面积,加快气体的吸收速率,
故答案为:增大气体与溶液的接触面积,加快气体的吸收速率;
(3)步骤2中锌粉和甲醛溶液、NaHSO3溶液发生氧化还原反应生成次硫酸氢钠甲醛和氢氧化锌沉淀,反应方程式为NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2,
故答案为:NaHSO3+HCHO+Zn+H2O=NaHSO2•HCHO+Zn(OH)2;
(4)次硫酸氢钠甲醛具有强还原性,遇到空气中的氧气易被氧化,所以步骤3中在真空容器中蒸发浓缩的原因是防止温度过高使产物分解,也防止氧气将产物氧化,
故答案为:防止氧气将产物氧化;
(5)①洗涤不干净,会附着氯化钡,检验沉淀是否洗净方法:取最后一次洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若无白色沉淀,说明已经洗净,若有白色沉淀,则未洗净,
故答案为:取最后一次洗涤液少许于试管中,滴加HNO3酸化的AgNO3溶液,若无白色沉淀,说明已经洗净,若有白色沉淀,则未洗净;
②由NaHSO2•HCHO•2H2O+2I2=NaHSO4+HI+HCHO、NaHSO4+BaCl2=BaSO4↓+HCl+NaCl,可得关系式:NaHSO2•HCHO•2H2O~BaCl2,硫酸钡的质量为0.466g,其物质的量为$\frac{0.466g}{233g/mol}$=0.002mol,所以样品中纯NaHSO2•HCHO•2H2O的质量为0.002mol×$\frac{100ml}{20ml}$×154g/mol=1.54g,所以纯度=$\frac{1.54g}{2g}$×100%=77%,
故答案为:77%.
点评 本题考查物质制备实验,为高考常见题型,涉及对原理与操作的分析评价、对装置的分析评价、仪器的使用、实验方案设计、物质含量测定等,题目比较综合,是对学生综合能力的考查,难度中等.

| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃烧热为-1559.9 kJ•mol-1,则乙烷燃烧的热化学方程式可表示为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
| A. | 92.3% | B. | 75% | C. | 66.75% | D. | 不能确定 |
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |
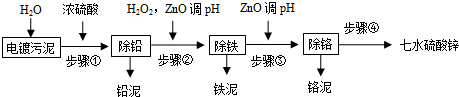
已知:
①各离子开始沉淀和完全沉淀的pH值如下表:
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |
(1)请写出步骤①除铅的离子方程式:Pb2++SO42-=PbSO4↓.
(2)步骤②加入双氧水的离子反应方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,调pH的范围是3.2~3.9.
(3)步骤③加入ZnO调pH的原理是(用离子方程式表示)Cr3++3H2O?Cr(OH)3+3H+、ZnO+2H+=Zn2++H2O;铬泥的主要成分是Cr(OH)3.
(4)步骤④的操作方法是蒸发浓缩、冷却结晶、洗涤、干燥.
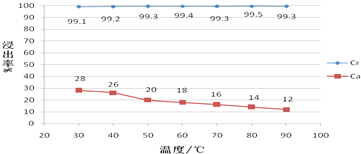
(5)由图可以看出在硫酸浸出Ca2+、Cr3+离子的过程中,Ca2+离子浸出率随温度的升高而减小,其原因是硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低,Cr3+离子浸出率受温度影响较小,可在常温下浸出,但在实验过程中为了降低溶液的黏度,改善浸出液的过滤性能,浸出液的温度维持在40-50℃,浸出流程中虽然没有加热设备,但仍能使浸出液保持在40-50℃的原因是浓硫酸稀释过程中会放出大量的热,浸出渣的主要成分是硫酸铅、硫酸钙.

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥.
(6)在蒸馏操作中,仪器选择及安装都正确的是b(填标号).
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”),其原因是会收集少量未反应的异戊醇.
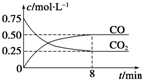 某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:(1)0~8min,v(CO)=0.0625mol•L-1•min-1.
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是AD(填序号).
A.温度B.铁粉的量(足量)C.压强D.CO的量
(3)已知:反应Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2.不同温度时K1、K2的值如下表:
| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
①温度为973K时:K=0.62;
②温度为1173K时:K=1.29;
③反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
| A. | H2SO4 | B. | CO2 | C. | NaOH | D. | HNO3 |
