题目内容
10.A、B、C、D、E、F、G为短周期主族元素,且原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;E元素原子的最外层电子数等于其电子层数,C和F同主族,C和F的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸.请根据以上信息回答下列问题.(1)F元素在元素周期表中的位置是第三周期第VIA族.
(2)E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(3)写出含有A、C、G元素具有漂白性物质的结构式H-O-Cl.
(4)化合物D2C中阴离子半径比阳离子半径大(填“大”或“小”,用电子式表示D2C的形成过程
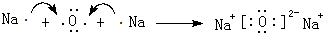 .
.(5)25.6g铜与一定浓度的B的最高价氧化物的水化物反应,产生标准状况下BO、BO2混合气8.96L,则参加反应的B的最高价氧化物的水化物物质的量为1.2mol.
分析 A、B、C、D、E、F、G为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素,则A为氢元素;D的+1价阳离子与氖原子具有相同的电子层结构,则D为钠元素;E元素原子的最外层电子数等于其电子层数,原子序数大于钠,则E为Al;C和F同主族,C和F的原子序数之和是A和D的原子序数之和的2倍,则C为氧元素,F为硫元素,G是原子序数大于硫的短周期元素,所以G为氯元素;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸,则B为氮元素.
解答 解:A、B、C、D、E、F、G为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素,则A为氢元素;D的+1价阳离子与氖原子具有相同的电子层结构,则D为钠元素;E元素原子的最外层电子数等于其电子层数,原子序数大于钠,则E为Al;C和F同主族,C和F的原子序数之和是A和D的原子序数之和的2倍,则C为氧元素,F为硫元素,G是原子序数大于硫的短周期元素,所以G为氯元素;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸,则B为氮元素.
(1)F为硫元素,位于周期表中第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)E的最高价氧化物为氧化铝,D的最高价氧化物的水化物为NaOH,二者反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)含有A、C、G元素具有漂白性物质为HClO,其结构式为H-O-Cl,
故答案为:H-O-Cl;
(4)化合物Na2O中阴离子、阳离子的电子层结构相同,故阴离子半径大于阳离子半径,用电子式表示Na2O的形成过程: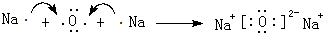 ,
,
故答案为:大;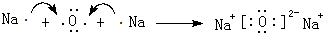 ;
;
(5)25.6g铜与一定浓度的硝酸反应,产生标准状况下NO、NO2混合气8.96L,其物质的量为$\frac{8.96L}{22.4L/mol}$=
0.4mol,Cu的物质的量为$\frac{25.6g}{64g/mol}$=0.4mol,参加反应的硝酸转化为硝酸铁、NO、NO2,根据N原子守恒可知,参加反应的硝酸的物质的量为0.4mol×2+0.4mol=1.2mol,
故答案为:1.2mol.
点评 本题考查结构性质位置关系应用,关键是推断元素,侧重对化学用语与元素化合物性质的考查,(5)中注意利用守恒法计算解答.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 将盐卤或石膏加入豆浆,制成美味可口的豆腐 | |
| B. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀,即可制得Fe(OH)3胶体 | |
| C. | 放电影时,放映室射到屏幕上的光柱 | |
| D. | 在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深 |
| A. | 镁在空气中或纯净氧气中燃烧的产物都只有MgO | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 将四氧化三铁溶解于过量的硝酸中,所得溶液中无Fe2+ | |
| D. | 氯化铝和过量的氨水反应一定得到Al(OH)3沉淀 |
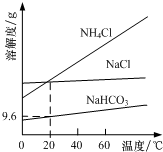 以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )
以NaCl、CO2、NH3为原料发生反应,制得NaHCO3和NH4Cl是“侯氏制碱法”的重要步骤.相关物质的溶解度曲线如图所示.下列说法不正确的是( )| A. | 将NaHCO3加热分解可得纯碱 | |
| B. | 常温下碳酸氢钠的溶解度大于碳酸钠 | |
| C. | 采用蒸发结晶从溶液中分离出NaHCO3 | |
| D. | 20℃时,NaHCO3饱和溶液的物质的量浓度约为1.1mol/L |
| A. | NH4+中质子数与电子数 | B. | NH4HSO4晶体中阳离子与阴离子 | ||
| C. | OH-中电子数与中子数 | D. | Na2O2中阳离子与阴离子 |
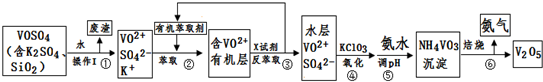
请回答下列问题:
(1)步骤①所得废渣的成分是SiO2(写化学式),操作I的名称过滤.
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移提高了钒的萃取率.
③中X试剂为硫酸.
(3)④的离子方程式为NH3•H2O+VO3-═NH4VO3↓+OH-.
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有有机萃取剂和氨气.
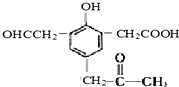 ,试回答:
,试回答: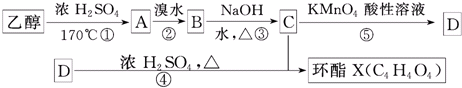
 +2H2O
+2H2O